Neurosteroïden als behandeling van post-partumdepressie: kritische literatuurstudie
Achtergrond Brexanolon (Zulresso) en zuranolon (Zurzuvae) zijn twee synthetische neuroactieve steroïden die respectievelijk in maart 2019 (als intraveneuze behandeling) en augustus 2023 (als orale behandeling) door de Amerikaanse Food and Drug Administration goedgekeurd werden voor de behandeling van post-partumdepressie. Tot op heden zijn deze producten niet beschikbaar op de Belgische en Nederlandse markt.
Doel De effectiviteit en bijwerkingen van brexanolon en zuranolon bij de behandeling van post-partumdepressie evalueren aan de hand van de bestaande dubbelblind placebogecontroleerde studies.
Methode Een klinisch georiënteerde literatuurstudie.
Resultaten Brexanolon en zuranolon zijn effectief in de behandeling van post-partumdepressie met een klinisch significante snelle respons in vergelijking met placebo. De voornaamste vermelde bijwerkingen zijn: duizeligheid, somnolentie en sedatie.
Conclusie Placebogecontroleerde studies ondersteunen de effectiviteit van de behandeling van post-partumdepressie met brexanolon en zuranolon, waarbij een snelle en statistisch significante verbetering van de stemmingsklachten werd gezien. De plaats van neurosteroïden binnen de praktijk is echter nog onduidelijk en moet door bijkomende studies en klinische ervaring duidelijk worden.
Depressie is een van de meest voorkomende aandoeningen gedurende de post-partumperiode, met wereldwijd prevalentiecijfers tussen de 5,5-23,5%.1,2 Suïcide is de oorzaak van ongeveer 20% van de post-partumsterfgevallen. Naast de impact op de vrouw zelf, is er ook een belangrijke impact onder meer op de moeder-kindrelatie, de mentale gezondheid van vaders alsook op de relationele tevredenheid.3,4 Ondanks deze ernstige gevolgen blijft post-partumdepressie vaak ondergediagnosticeerd en krijgt slechts 20% van de zwangere vrouwen met een depressie een passende behandeling.5
De NICE-richtlijnen adviseren, net zoals bij niet-post-partumdepressie, een duale aanpak met psychotherapeutische en farmacologische behandeling, bij matig tot ernstige symptomen. Wat betreft de farmacologische behandeling gaat de voorkeur uit naar SSRI’s en in tweede lijn SNRI’s of mirtazapine.5 Toch benadrukken de auteurs van een recente cochranereview de beperkte sterke evidentie betreffende de veiligheid en effectiviteit van antidepressiva post partum, zeker bij ernstige depressie en wanneer borstvoeding gegeven wordt.6,7
Recente inzichten wijzen op de mogelijke rol van neuroactieve steroïden (NAS) en gamma-aminoboterzuur (GABA) bij het ontstaan van post-partumdepressie (PPD).3 Het betreft de neurosteroïde allopregnanolon, die een hoogpotente positieve allosterische modulator is van de synaptische en extrasynaptische GABA-A-receptoren. Een stijging van de concentratie in het cerebrospinale vocht zorgt voor een downregulatie van het GABA-erge systeem.10 Na de bevalling daalt allopregnanolon met een upregulatie van het GABA-erge systeem tot gevolg. Een daling van allopregnanolon zonder de reactieve upregulatie van de GABA-A-kanalen blijkt een rol te hebben in het ontstaan van een post-partumdepressie. Vanuit deze hypothese kan een behandeling met NAS deze uitblijvende upregulatie van GABA-kanalen compenseren en de depressieve symptomen tegengaan.3
Ondertussen werden twee synthetische neuroactieve steroïden, brexanolon (Zulresso) en zuranolon (Zurzuvae), goedgekeurd door de Amerikaanse Food and Drug Administration voor de behandeling van PPD, respectievelijk in maart 2019 (als intraveneuze behandeling) en augustus 2023 (als orale behandeling).8,9 Tot op heden zijn deze producten echter nog niet beschikbaar op de Belgische en Nederlandse markt.
We willen met deze systematische review een onafhankelijk overzicht geven van de effectiviteit en veiligheid van deze beide allopreganolonen in de behandeling van een post-partumdepressie.
Methode
Zoekstrategie en studieselectie
We voerden een literatuuronderzoek uit in PubMed op 1 februari 2024. Studies werden gezocht met gebruik van de volgende (combinaties van) zoektermen: (‘Depression, postpartum’ OR ‘postpartum depression’ [tiab]) AND ‘neuroactive steroids’ [tiab] OR ‘neurosteroid’ [tiab] OR ‘ brexanolon’ [tiab] OR ‘zuranolone’ [tiab]). Enkel Engelstalige dubbelblinde, gerandomiseerde en placebogecontroleerde studies werden geïncludeerd door gebruik te maken van de filter ‘Randomised controlled trial’.
Resultaten
Via PubMed vonden we 53 klinische trials (gepubliceerd tot 1 februari 2024). Studies werden geselecteerd indien de focus van de RCT’s de behandeling betrof van een post-partumdepressie volgens de DSM-4 of DSM-5, het een behandeling betrof met een NAS en met focus op de effectiviteit en de veiligheid. We excludeerden 46 artikelen op basis van titel en abstract en na screening van de volledige tekst nog eens 3 artikelen. Ten slotte voldeden 4 RCT’s aan de inclusiecriteria van dit overzichtsartikel (zie figuur 1). Een aanvullende zoekstrategie op de databanken Embase en ScienceDirect leverde geen extra studies op.
Figuur 1. PRISMA-stroomschema zoekstrategie
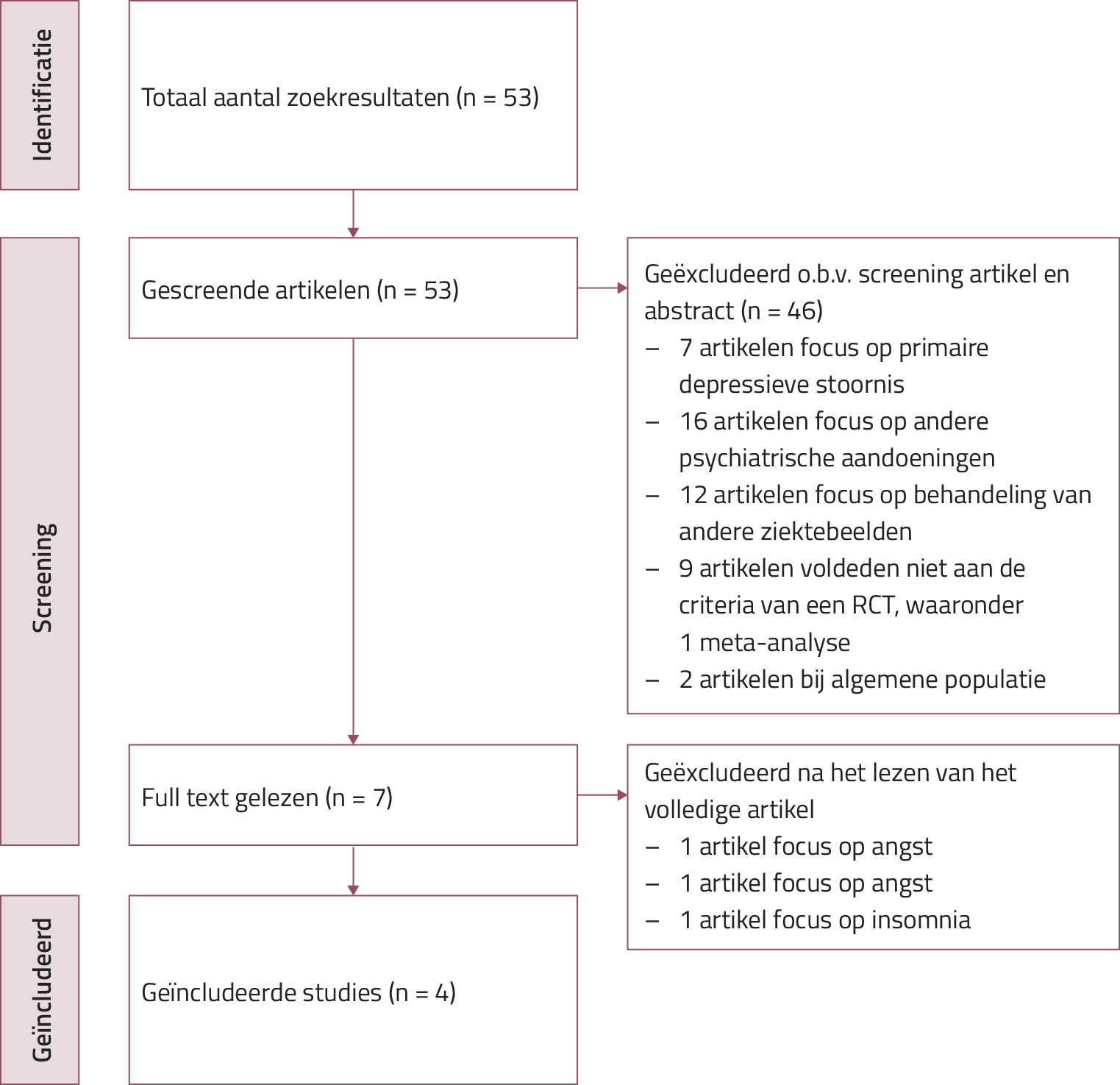
Kenmerken van geïncludeerde RCT’s
Een gestructureerde weergave van de relevantste studiekenmerken is online terug te vinden in tabel 1. Van de vier geïncludeerde dubbelblind gerandomiseerde placebogecontroleerde studies voor de behandeling van PPD werden er twee verricht met brexanolon en twee met zuranolon. Vrouwen tussen 18 en 45 jaar werden geïncludeerd met ernstige tot zeer ernstige depressieve stemmingsklachten, ontstaan in het 3de zwangerschapstrimester of in de eerste 4 weken post partum. Diagnosestelling vond plaats aan de hand van het gestructureerd klinisch interview voor de DSM-5-criteria. De ernst werd ingeschat met de Hamilton Rating Scale for Depression (HAM-D).
De primaire uitkomstmaat voor alle RCT’s was het verschil tussen de HAM-D-score aan het begin en aan het einde van de behandeling. Secundaire uitkomstmaten waren tussentijdse HAM-D-verschillen (exacte tijdstippen zie tabel 1), alsook het HAM-D-remissiepercentage (gedefinieerd als de proportie patiënten met een HAM-D-score ≤ 7) en het HAM-D-responspercentage (gedefinieerd als de proportie patiënten met minimaal 50% reductie in HAM-D-score). Andere relevante secundaire uitkomstmaten zijn te vinden in tabel 1.
Tabel 1. Kenmerken van de geïncludeerde RCT’s
|
1ste auteur; jaar |
Methode (deelnemers: compleet) |
Plaats |
Inclusie |
Interventie |
Dosis en vorm |
Duur |
Gem. leeftijd in j |
Primaire uitkomsten |
|
|
Brexanolon |
|||||||||
|
Kanes 201710 |
RCT/fase 2 (21/21) |
VS |
- Opgenomen ≤ 6 maanden post partum met start van symptomen 3de trim of <4 w na de bevalling - Baseline-HAMD > 26 |
Brexanolon 90 μg/kg/h (n = 10) of placebo (n = 11) |
30-90 μg/kg/h, iv |
30 dagen |
27,4 (5,3)/ 28,8 (4,6) |
Verschil t.o.v. baseline in HAMD-score na 60 h |
|
|
Meltzer-Brody 201811 |
1 |
RCT/fase 3 (138/113) |
VS |
- Opgenomen ≤ 6 maanden post partum met start van symptomen 3de trim of <4 w na de bevalling - Baseline-HAMD > 26 |
Brexanolon 90 μg/kg/h (n = 45), brexanolon 60 μg/kg/h (n = 47) of placebo (n = 46) |
30-90 μg/kg/h, iv |
30 dagen |
27,8 (6,0) 27,3 (6,1) 27,0 (6,0) |
Verschil t.o.v. baseline in HAMD-score na 60 h |
|
2 |
RCT/fase 3 (108/101) |
VS |
- Opgenomen ≤ 6 maanden post partum met start van symptomen 3de trim of <4 w na de bevalling - Baseline-HAMD = 20-25 |
Brexanolon 90 μg/kg/h (n = 54) of placebo (n = 54) |
30-90 μg/kg/h, iv |
30 dagen |
28,4 (6,1)/ 27,4 (5,9) |
Verschil t.o.v. baseline in HAMD-score na 60 h |
|
|
Zuranolon |
|||||||||
|
Deligiannidis 202112 |
RCT/ fase 3 (153/150) |
VS |
- Ambulant ≤ 6 maanden < post partum met start van symptomen 3de trim of <4 w na de bevalling - Baseline-HAMD > 26 |
Zuranolon 30 mg (n = 76) of placebo (n = 77) |
30 mg, PO |
45 dagen |
29,3 (5,4)/ 27,4 (5,3) |
Verschil t.o.v. baseline in HAMD-score op dag 15 |
|
|
Deligiannidis 202313 |
RCT/fase 3 (196/170) |
USA |
- Ambulant ≤ 6 maanden post partum met start van symptomen 3de trim of <4w na de bevalling - Baseline-HAMD > 26 |
Zuranolon 30 mg (n = 98) of placebo (n = 98) |
50 mg, PO |
45 dagen |
30,0 (5,9)/ 31,0 (6,0) |
Verschil t.o.v. baseline in HAMD-score op dag 15 |
|
Klinisch relevante exclusiecriteria betroffen een voorgeschiedenis van bipolaire stoornis, psychotische stoornis, alcohol- en of middelenafhankelijkheid en de aanwezigheid van actieve suïcidaliteit alsook suïcidaliteit in de voorgeschiedenis. Borstvoeding diende gestaakt te worden gedurende de behandeltermijn en tot 1 week na stopzetting van de behandeling; wens tot voortzetting werd beschouwd als een exclusiecriteria. Een gelijktijdige behandeling met een ander psychofarmacon was mogelijk, indien er sprake was van een stabiele onderhoudsdosis (= vaste dosering, afhankelijk van de studie vanaf 14 of 30 dagen, voor de start van de studie).10-13
Effectiviteit en veiligheid in klinische studies
Relevante studieresultaten zijn weergegeven in tabel 2.
Tabel 2. Resultaten van de RCT’s
|
1ste auteur; jaar |
Baseline (gem.; |
Verandering t.o.v. baseline (SD) |
Verschil |
Respons |
Remissie (HAM-D-score < 7) |
Bevindingen |
|
|
Brexanolon |
|||||||
|
Kanes 201710 |
Baseline-HAM-D > 26 Br90: 28,1 (27,0-30,0) Pl: 28,8 (26,0-32,0) |
Br90: -21,0 (2,9) Pl: -8,8 (2,8) |
- 12,2 (p = 0,0075) |
Br90: 70% Pl: 36% P = 0,1450 |
Br90: 70 % Pl: 9% p = 0,0364 |
Primair: 1. Statistisch significant verschil HAM-D op 60 h. Secundair: 1. Statistisch significant verschil HAM-D vanaf 24 h en persisterend na 30 dagen. 2 Statistisch significant remissiepercentage na 60 h en persisterend na 30 dagen. 3. Geen statistisch significant responspercentage op 60 h, wel op 72 h en op dag 7. 4. Statistisch significante respons op de CGI-I op 60 h. |
|
|
Meltzer-Brody 201811 |
1 |
Baseline-HAM-D > 26 Br90: 28,4 (2,5) Br60: 29,1 (2,7) Pl: 28,6 (2,5) |
Br90: -17,7 (1,2) Br60: -19,5 (1,2) Pl: -14,0 (1,1) |
Br90: -3,7 (p = 0,0252) Br60: -5,5 (p = 0,0016) |
Geen waarde gerapporteerd |
Geen waarde gerapporteerd |
Primair: 1. Statistisch significant verschil HAM-D op 60 h. Secundair: 1. Statistisch significant verschil in HAM-D-score vanaf 24 h en alle tijdstippen nadien. 2. Statistisch significant remissie vanaf 24 h en persisterend na 30 dagen. 3. Statistisch significante respons op 60 h. 3. Statistisch significante respons op de CGI-I op 60 h. |
|
2 |
Baseline-HAM-D > 20 B90: 22,6 (1,6) Pl: 22,7 (1,6) |
Br90: -14,6 (0,8) Pl: -12,1 (0,8) |
Br90: – 2,5 (p=0,0160) |
Geen waarde gerapporteerd |
Br90: 61 % Pl: 38% p=0,003 |
Primair: 1. Statistisch significant verschil HAM-D op 60 h Secundair: 1. Statistisch significant verschil in HAM-D vanaf tijdstip 48 h en tot dag 7, verlies van significantie op dag 30. 2. Statistisch significante remissie op 60 h. 3. Statistisch significante respons tussen 48 h en dag 7. 4. Statistisch significante respons op de CGI-I op 60 h. |
|
|
Zuranolon |
|||||||
|
Deligiannidis 202112 |
Baseline-HAM-D > 26 Z: 28,4 (2,0) Pl: 28,8 (2,0) |
Z: – 17,8 (-6,9) (D15) Pl: -13,6 (-1,5) (D15) |
- 4,2 (p = 0,003) |
Z: 72 % (D15) 75% (D45) Pl: 48% (D15) 57 % (D45) p = 0,05 (D15) 0,02 (D45) |
Z: 45% (D15) 53% (D45) Pl: 23 % (D15) 30% (D45) p = 0,01 (D15), 0,009 (D45) |
Primair: 1. Statistisch significante daling in HAM-D-score op dag 15. Secundair: 1. Statistisch significante daling op dag 3 en 45. 2. Statistisch significante respons & remissiepercentage op dag 15 en dag 45. 3. Statistisch significante respons op de CGI-I op dag 15. |
|
|
Deligiannidis 202313 |
Baseline-HAM-D > 26 Z: 28,6 (2,5) Pl: 28,8 (2,3) |
Z: – 15, 6 (-0,82) (D15) Pl: – 11,6 (-0,82) (D15) |
- 4,0 (p = 0,001) |
Z: 57 % (D15) Pl: 38,9% (D15) p = 0,02 |
Z: 26,9% (D15) 44% (D45) Pl: 16,7% (D15) 29,4% (D45) p = 0,11 (D15), 0,03 (D45) |
Primair: 1. Statistisch significante daling in HAM-D op dag 15. Secundaire: 1. Statistisch significante daling in HAM-D-score op dag 3, 28 en 45. 2. Statistisch significante respons op dag 15. 3. Geen statistisch significante remissie op dag 15, wel op dag 45. 3. Statistisch significante respons op de CGI-I op dag 15. |
|
Br: brexanolon, CGI-I: Clinical Global Impressions Scale, HAM-D: Hamilton Depression Rating Scale, IQR: interkwartielafstand, Pl: placebo, SD: standaarddeviatie.
D = dag, Z: zuranolon.
Brexanolon
In de fase 2-studie van Kanes e.a. (2017) werden 21 vrouwen met een ernstige post-partumdepressie (HAM-D-baseline > 26) gerandomiseerd in twee groepen: groep 1 werd behandeld met brexanolon intraveneus (iv) gedurende 60 h (n = 10) en groep twee met placebo (n = 11).10 De toedieningsvorm van placebo is onduidelijk. Het aantal patiënten onder een stabiele dosis van antidepressiva werd gelijk verdeeld over beide groepen: 30% (n = 3) in de brexanolon- en 27% (n = 3) in de placebogroep. Na 36 h werd een statistisch significant verschil in symptoomvermindering gemeten in de brexanolongroep in vergelijking met de placebogroep (12,0 punten verschil op de HAM-D; p = 0,0078; ES 1,2), met een aanhoudend significant verschil in symptoomvermindering na 60 h (12,2 punten verschil op de HAM-D; p = 0,0075). Ook na stopzetting van de therapie, 30 dagen na de start van de behandeling, bleef het significant effect aanhouden (11,9 punten verschil op de HAM-D; p = 0,0095). Brexanolon werd in het algemeen goed verdragen. De behandeling werd bij geen enkele deelnemer onderbroken wegens bijwerkingen. De meest gerapporteerde bijwerkingen waren: duizeligheid (n = 2) en somnolentie (n = 2).
In de multicentrische fase 3-studie van Meltzer-Brody e.a. (2018) werden 375 patiënten met een post-partumdepressie in 2 dubbelblinde RCT’s onderverdeeld.11 De eerste RCT betrof vrouwen met depressieve stemmingsklachten met HAM-D-baseline > 26. 138 patiënten werden gerandomiseerd in groep 1, groep 2 en groep 3, die respectievelijk behandeld werden met van iv brexanolon 90 μg/kg (n = 45), 60 μg/kg (n = 47) of placebo (n = 46) (studie 1). In de tweede dubbelblinde RCT werden de resterende 108 patiënten met een HAM-D-baseline van 20-26 gerandomiseerd in twee groepen: groep 1 werd behandeld met iv brexanolon 90 μg/kg, groep 2 met placebo (studie 2).
De eerste studie toonde een statistisch significant verschil in de totale HAM-D-score na 60 uur (primaire uitkomstmaat), tussen de Brex90/Brex60-groep en placebo. Voor de exacte verschillen in HAM-D-scores en p-waardes verwijzen we naar tabel 2 (online). Dit significante verschil werd waargenomen vanaf 24 h en hield aan tot en met het einde van de studie (dag 30). In de tweede studie werd eveneens een significant verschil gerapporteerd voor de totale HAM-D-score tussen de brexanolongroep en de placebogroep na 60 h. Dit verschil bleef echter niet statistisch significant aan het einde van de studie op dag 30. Subgroepanalyses van de HAM-D-scores werden verricht voor verschillende factoren: ras, leeftijd, etniciteit, BMI, familiale voorgeschiedenis, persoonlijke voorgeschiedenis en het begin van symptomen. Hierbij konden geen significante verschillen worden aangetoond.
Over beide studies heen nam 22% patiënten voorafgaand aan inclusie een stabiele dosis antidepressiva. Door middel van een geïntegreerde analyse werd het verschil in symptoomvermindering bepaald tussen patiënten met of zonder voorafgaande onderhoudsbehandeling met antidepressiva bij de behandelingsgroepen met brexanolon 90 μg/kg. Er konden hierbij geen verschillen in klinische verbetering vastgesteld worden tussen patiënten zonder antidepressiva (- 4,3; p < 0,0001) en degenen met antidepressiva (- 4,5; p = 0,0282).
Ongewenste effecten, zoals hoofdpijn, duizeligheid en somnolentie, werden gerapporteerd door 30% van de patiënten. Bij 4% (n = 5) van de patiënten in de brexanolongroepen (n = 130) werd ernstige sedatie met bewustzijnsverlies geobserveerd (1 in de brex60- en 4 in de brex90-groep). Na stopzetten van de behandeling werd na 15 minuten het bewustzijn herwonnen en werd volledig herstel waargenomen na 90 minuten. Bij geen enkele patiënt was er hemodynamische instabiliteit of respiratoire insufficiëntie. De overige bijwerkingen werden als licht gerapporteerd en behandeling kon worden voortgezet.
Zuranolon
In de eerste multicentrische fase 3-studie van Deligiannidis e.a. (2021) werden 153 patiënten met een post-partumdepressie gerandomiseerd in 2 groepen.12 Groep 1 werd behandeld met oraal zuranolon 30 mg/dag (n = 76) gedurende 14 dagen, groep 2 werd behandeld met placebo (n = 77). Respectievelijk 21 en 18% van de patiënten nam een stabiele onderhoudsdosis antidepressiva bij de start van de studie. Op dag 15 werd een statistisch significante daling in HAM-D-score gemeten, met een vermindering van 17,8 punten in de zuranolongroep tegenover 13,6 punten in de placebogroep (verschil van -4,9 punten; p = 0,003).
Het merendeel van de gerapporteerde bijwerkingen was licht tot matig, waarbij het meest werden gerapporteerd: somnolentie (15%; n = 12), hoofdpijn (9%; n = 9) en duizeligheid (8%; n = 6). Bij 4% (n = 3) van de patiënten was er een ernstige bijwerking: sedatie (n = 1), verwardheid (n = 1) of migraine (n = 1). Bij 1 patiënt (1 %) was er zeer ernstige verwardheid. Na dosisverlaging, van 30 mg naar 20 mg, kon de behandeling wel worden voortgezet.
In een tweede multicentrische fase 3-studie gepubliceerd door Deligiannidis e.a. (2023),13 werden 196 patiënten met een post-partumdepressie gerandomiseerd naar een groep met oraal zuranolon 50 mg/dag (n = 98) gedurende 14 dagen of een placebogroep (n = 98). De primaire en secundaire uitkomstmaten waren vergelijkbaar en dit gold ook voor de bevindingen (zie online tabel 2). Op dag 15 werd een statistisch significante daling in de HAM-D-17 gemeten met een vermindering van 15,6 punten in de zuranolongroep tegenover 11,6 punten in de placebogroep (verschil van -4,0 punten; p = 0,001). Als effectmaat werd Cohens d gerapporteerd. Voor 50 mg/dag was Cohens d op de totale HAM-D-17-score 0,52. Ook op dag 3 en dag 45 werd een significant verschil gerapporteerd. Er werd geen verschil gevonden in verbetering van de symptomen bij gelijktijdig gebruik van antidepressiva.
Respectievelijk 60% (n = 59) en 41,8% (n = 41) van de patiënten in de zuranolon- en de placebogroep rapporteerde bijwerkingen. In de zuranolongroep leidde dit tot dosisreductie naar 40 mg/dag bij 16,3% (n = 16). Bijwerkingen leidend tot dosisreductie waren de volgende: somnolentie (7,1%; n = 7), duizeligheid (6,1%; n = 6) en sedatie (3,1 %; n = 3). Na het stopzetten van de behandeling werden symptomen van onttrekking gemeten met de Physician Withdrawal Checklist (PWC-20). Er konden geen symptomen van onttrekking worden vastgesteld.
Bespreking
Vier dubbelblinde placebogecontroleerde studies ondersteunen de effectiviteit van allopregnanolonen in de behandeling van post-partumdepressie.10-13 De daling in HAM-D-scores bleek statistisch significant groter te zijn bij de allopregnanolonen in vergelijking met placebo. Desondanks blijft het absolute verschil klein, mede door het aanzienlijk effect van placebo. Hierdoor staat de klinische relevantie ter discussie. In tegenstelling tot de werkingsduur van klassieke antidepressiva, is er een significant snellere respons na behandeling met zowel brexanolon als zuranolon. Een dergelijke snelle interventie is opportuun bij ernstige post-partumdepressie, met impact op de eigen gezondheid, die van de baby en bij uitbreiding het volledige gezin. Een ander voordeel ten opzichte van de bestaande antidepressiva is de korte behandelduur van 60 h (iv) tot 14 d (oraal).
Momenteel zijn er geen studies die de effectiviteit en veiligheid van beide allopregnanolonen onderling vergelijken. Vanuit praktische redenen geniet een orale toediening gedurende 14 dagen de voorkeur ten opzichte van intraveneuze behandeling over 60 h. Zorgvuldige klinische afweging is cruciaal, mede gezien de aanzienlijke kosten van de behandeling van zuranolon, geschat op 15.000 dollar per 2 weken behandeling.14 Hierbij dienen economische overwegingen in balans te worden gebracht met mogelijke therapeutische voordelen, zeker gezien de tamelijk beperkte kosten van de reeds bestaande psychotherapeutische of medicamenteuze behandelingen. Een vergelijkende kosten-effectiviteitsstudie met SSRI’s zou hier meer inzicht in kunnen geven.
Het veronderstelde werkingsmechanisme van allopregnanolonen is het opvangen van het aanwezige deficit in neurosteroïden. Critici wijzen echter naar het vergelijkbare biologische aangrijpingspunt van benzodiazepines.15 Er lijkt ook een vergelijkbaar bijwerkingenprofiel te bestaan met vermelding van duizeligheid, somnolentie en sedatie. De behandeling van depressieve stemmingsklachten door middel van een benzodiazepine als monotherapie of als add-onbehandeling, werd reeds onderzocht met vergelijkbare positieve bevindingen.16 Zogenaamde human abuse potential(HAP)-studies, waarbij het potentieel verslavend karakter van een product wordt opgespoord, bevestigen dat brexanolon en zuranolon een potentieel verslavend effect hebben, vergelijkbaar met alprazolam.8-9 Verder onderzoek is nodig om aan te tonen dat allopregnanolonen effectiever en veiliger zijn dan benzodiazepines. Indien dit niet zo zou blijken te zijn, lijkt er geen meerwaarde te bestaan.
De generaliseerbaarheid van voorgaande conclusies naar de dagelijkse praktijk kan om methodologische redenen ter discussie gesteld worden. De beschikbare studies zijn alle door de farmaceutisch industrie gefinancierd en vonden alle plaats in de VS, zonder betrekking van Europese patiëntenpopulatie. Inclusiecriteria zijn sterk beperkend met impact op generaliseerbaarheid, dit door enkel patiënten met ernstige tot zeer ernstige depressieve stemmingsklachten (HAM-D >26 of 20-26) te includeren en enkel diegene met aanvang van symptomen tussen het 3de zwangerschapstrimester en 4 weken post partum. Hierdoor dreigt een aanzienlijke groep van vrouwen met post-partumdepressie niet in aanmerking te komen voor een behandeling met NAS.17
Ook de toepasbaarheid in de dagelijkse praktijk kan een probleem vormen, dit doordat borstvoeding steeds werd opgenomen als exclusiecriterium. Bijgevolg zijn er geen gegevens beschikbaar over het effect van neurosteroïden op zuigelingen, wat een inherent probleem vormt bij deze doelgroep. Ten slotte zijn de langetermijneffecten van deze nieuwe medicatie alsook de bijhorende kosten onbekend, gezien de beperkte follow-upperiode van de beschikbare studies.
Conclusie
Wij onderzochten in deze literatuurstudie het wetenschappelijk bewijs voor neurosteroïden als behandeling voor post-partumdepressie. Dubbelblinde placebogecontroleerde studies ondersteunen de effectiviteit van deze behandeling, waarbij een snelle en statistisch significante verbetering van de stemmingsklachten werd gezien ten opzichte van placebo. De plaats van neurosteroïden binnen de praktijk is echter nog onduidelijk gezien de twijfels over de generaliseerbaarheid van de bestaande studies, de klinisch relevante meerwaarde ten opzichte van huidige behandelingen, het potentieel verslavend karakter en de onbekende langetermijneffecten.
Literatuur
1 Frieder A, Fersh M, Hainline R, e.a. Pharmacotherapy of postpartum depression current approaches and novel drug development. CNS Drugs 2019; 33: 265-82.
2 Howard LM, Molyneaux E, Dennis CL, e.a. Non-psychotic mental disorders in the perinatal period. Lancet 2014; 384: 1775-88.
3 Gunduz-Bruce H, Takahashi K, Huang M. Development of neuroactive steroids for the treatment of postpartum depression. J Neuroendocrinol 2022; 34: e13019.
4 Lindahl V, Pearson JL, Colpe L. Prevalence of suicidality during pregnancy and the postpartum. Arch Womens Ment Health 2005; 8: 77-87.
5 Vigod SN, Wilson CA, Howard LM. Depression in pregnancy. BMJ 2016; 352: i1547.
6 Brown JV, Wilson CA, Ayre K, e.a. Antidepressant treatment for postnatal depression. Cochrane Database Syst Rev 2021; 2: CD013560.
7 National Institute for Health and Care Excellence. Antenatal and postnatal mental health: clinical management and service guidance: Interventions for depression. 2022. www.nice.org.uk/guidance/cg192
8 U.S. Food and Drug Administration. Highlights of Prescribing Information: ZULRESSO (brexanolone). U.S. Food and Drug Administration; 2019.
9 U.S. Food and Drug Administration. NDA217369 Integrated Review Zurzuvae (Zuranolone). U.S. Food and Drug Administration; 2022.
10 Kanes S, Colquhoun H, Gunduz-Bruce H, e.a. Brexanolone (SAGE-547 injection) in post-partum depression: A randomised controlled trial. Lancet 2017; 390: 480-9.
11 Meltzer-Brody S, Colquhoun H, Riesenberg R, e.a. Brexanolone injection in post-partum depression: Two multicentre, double-blind, randomised, placebo-controlled, phase 3 trials. Lancet 2018; 392: 1058-70.
12 Deligiannidis KM, Meltzer-Brody S, Gunduz-Bruce H. Effect of Zuranolone vs placebo in postpartum depression a randomized clinical trial. JAMA Psychiatry 2021; 78: 951-9.
13 Deligiannidis KM, Meltzer-Brody S, Maximos B, e.a. Zuranolone for the treatment of postpartum depression. Am J Psychiatry 2023; 180: 668-75.
14 Li Z, Wu Q, Peng P, e.a. Efficacy and safety of zuranolone for the treatment of depression: A systematic review and meta-analysis. Psychiatry Res 2024; 331: 115640.
15 Kleinman RA, Schatzberg AF. Understanding the clinical effects and mechanisms of action of neurosteroids. Am J Psychiatry 2021; 178: 221-3.
16 Ogawa Y, Takeshima N, Hayasaka Y, e.a. Antidepressants plus benzodiazepines for adults with major depression. Cochrane Database Syst Rev 2019; 6: CD001026.
17 Wisner KL, Sit DK, Mschea MC, e.a. Onset timing, thoughts of self-harm, and diagnoses in postpartum women with screen-positive depression findings. JAMA Psychiatry 2013; 70: 490-8.
Auteurs
Jasmine Sondervan, arts in opleiding tot psychiater, UZ Gent.
Arne Hostens, arts in opleiding tot neuroloog, VUB, UZ Brussel.
Gilbert Lemmens, psychiater, afd. Psychiatrie, UZ Gent, hoofddocent psychiatrie, vakgroep Hoofd en Huid, UGent.
Correspondentie
Jasmine Sondervan (jasmine.sondervan@ugent.be).
Geen strijdige belangen gemeld.
Het artikel werd voor publicatie geaccepteerd op 16-10-2024.
Citeren
Tijdschr Psychiatr. 2025;67(1):15-19
