Klinische gedragsactivatie bij depressie: eerste effectmeting van multimodaal programma
Achtergrond Gedragsactivatie heeft zich steeds meer ontwikkeld als zelfstandige therapie, omdat het een haalbare en effectieve behandeling voor depressie blijkt te zijn. De Richtlijn Depressie beveelt gedragstherapeutische interventies aan tijdens (klinische) behandeling van depressie.
Doel Beschrijven van de opzet van een 12-daags klinisch en geïntegreerd, multimodaal behandelprogramma voor intensieve gedragsactivatie bij depressie en van een eerste toets van het effect op de mate van depressieve klachten, totale psychische klachten en vitaliteit. Daarnaast werd de interactie met therapieresistentie getoetst.
Methode Retrospectief dossieronderzoek onder patiënten die deelnamen aan het programma in de periode mei 2019-september 2022. Met lineaire mixed-modelanalyses werden de verandering over de tijd (tijd + tijd2) van de ervaren depressieve klachten (Beck Depression Inventory, BDI), totale psychische klachten en vitaliteit (Symptom Questionnaire – 48) onderzocht.
Resultaten Van de 107 deelnemers gaven 54 retrospectief toestemming voor gebruik van hun gegevens en konden de gegevens van 50 deelnemers gebruikt worden voor de studie. Uit de resultaten bleek dat er een significante verandering van depressieve klachten en totale psychische klachten over tijd was, die bij follow-up iets terugliep. De gecorrigeerde gemiddelde BDI-score daalde van 32,96 bij aanvang naar 28,96 bij afronding van het klinische programma en naar 28,20 een tot drie maanden na het klinische programma. Voor de mate van vitaliteit was er geen significant tijdseffect. Daarnaast was er geen interactie-effect van therapieresistentie*tijd op het effect van de behandeling.
Conclusie Gedragsactivatie in een multimodaal klinisch behandelprogramma, waarin het betrekken van naasten, zingeving, waardegericht werken en fysiek activeren een plek hebben, lijkt potentie te hebben als manier om de vicieuze cirkel van ernstige depressieve klachten te doorbreken, waardoor verdere behandeling ambulant te vervolgen is. De beperkingen van dit onderzoek vragen echter om een replicatie van de doelen in vervolgonderzoek met een grotere steekproef en inclusie van meer contextvariabelen.
Een ernstige depressie is een van de meest voorkomende psychische ziekten en heeft een hoge gezondheidslast.1 Volgens de Nederlandse Richtlijn Depressie zijn psychotherapeutische en medicamenteuze behandelingen aanbevolen bij matige aanhoudende of ernstige depressieve klachten.2 Cognitieve gedragstherapie (CGT) is een veelgebruikte psychotherapeutische behandeling voor depressie. Deze therapie is primair gericht op het vervangen van irrationele cognities die zorgen voor disfunctioneel gedrag, door meer constructieve en positieve gedachten. Gedragsactivatie als component van CGT blijkt uit onderzoek een belangrijke invloed te hebben op het therapieresultaat.3 Eerder is aanbevolen gedragstherapeutische interventies door verpleegkundigen in te zetten tijdens klinische behandeling van depressie.2,4
Gedragsactivatie, een kortdurende gestructureerde psychotherapeutische benadering, heeft tot doel a. waardevolle activiteiten te vergroten, b. activiteiten die een depressie onderhouden of het risico op depressie verhogen te verminderen, en c. problemen op te lossen die de toegang tot de waardevolle activiteiten beperken of die vermijding in stand houden.5,6 De therapie is gericht op de vicieuze cirkel van het verminderen van initiatief en vermijden van activiteiten en contacten, waardoor geen plezierige activiteiten plaatsvinden en gevoelens van somberheid, falen, zinloosheid en eenzaamheid zich ontwikkelen.7
Gedragsactivatie heeft zich in toenemende mate als een zelfstandige therapie ontwikkeld, mede omdat het een effectieve behandeling lijkt te zijn. Zo liet een meta-analyse van 45 gerandomiseerde studies met in totaal 3328 personen zien dat het effect op de ernst van depressie ten opzichte van standaardzorg medium is (Cohens d = 0,52; 95%-BI: 0,34-0,71) en ten opzichte van de wachtlijst groot is (Cohens d = 1,15; 95%-BI: 0,90-1,40). Dit is vergelijkbaar met het effect van cognitieve herstructurering of CGT, waarvan gedragsactivatie een onderdeel is.8 In een andere meta-analyse van 28 studies (1853 personen) blijkt dat gedragsactivatie even effectief is als andere psychotherapie of antidepressiva (Hedges’ g = 0,15; 95%-BI: -0,02-0,33) en aanzienlijk effectiever dan wachtlijst, placebomedicatie of ondersteunende begeleiding (Hedges’ g = 0,83; 95%-BI: 0,58-1,08).9 Ook gedragsactivatie in groepsverband is effectief.10
Gedragsactivatie is toepasbaar en aanvaardbaar in een klinische setting.11 Omdat gedragsactivatie minder (complexe) behandelcompetenties vraagt dan CGT, kan deze behandeling effectief gegeven worden door een bredere groep zorgverleners, ook door de verpleegkundigen die een belangrijk onderdeel zijn van klinische (groeps)behandelingen. Dit draagt bij aan de kosteneffectiviteit en implementeerbaarheid van de interventie. Het vergelijkbare uitvalspercentage van gedragsactivatie in groepsverband (14%) versus actieve controles in groepsverband (17%) of individuele psychotherapie (20%) suggereert een goede verdraagbaarheid.10 Ten slotte is er na gedragsactivatie minder terugval dan na medicamenteuze behandeling.12,13
Gedragsactivatie blijkt een effectieve en goed toepasbare psychotherapeutische behandeling voor depressie,14 en het aantal therapiesessies per week hangt samen met een beter behandelresultaat.15 We ontwikkelden in 2019 een kort klinisch gedragsactiverend behandelprogramma bij matige aanhoudende of ernstige depressie, onder de naam ‘Moodcamp’. Hoewel er meer methoden zijn om gedragsactivatie uit te voeren, kozen we vanwege de aandacht voor persoonlijke waarden voor het behandelprotocol van Lejuez e.a.16 Dit protocol, oorspronkelijk ontwikkeld voor 10 wekelijkse sessies, gebruikten we als basis voor een klinische 12-daagse behandeling. Deelnemers worden gemotiveerd gedrag dat de depressie in stand houdt, te doorbreken. Zij leren om niet hun stemming, maar hun persoonlijk plan te volgen (zie online supplement voor de inhoud van het programma).
Het doel was te onderzoeken in welke mate dit behandelprogramma: 1. effect had op de depressieve klachten, 2. effect had op de totale ervaren psychische klachten en vitaliteit – als maat voor positief psychologisch functioneren, en 3. of therapieresistentie het effect beïnvloedt. Een significante afname in depressieve en totale ervaren psychische klachten en een toename in vitaliteit werd verwacht, onafhankelijk van de mate van therapieresistentie.
Methode
Opzet en populatie
Wij verrichtten een observationele cohortstudie met retrospectief dossieronderzoek. De onderzoekspopulatie bestond uit alle patiënten die in de periode mei 2019-september 2022 waren gestart met deze behandeling.
Inclusiecriteria voor deelname aan de Moodcamp waren: A. ernstige depressieve klachten, B. ≥ 18 jaar, C. voldoen aan de volgende criteria: 1. uitval op meerdere levensgebieden (inactiviteit op bijv. werkgebied), 2. onvoldoende of onhaalbaar herstel via ambulante individuele/groeps-CGT en/of farmacotherapie, 3. actieve behandelbereidheid, 4. voldoende basis voor een goede werkrelatie, 5. bereidheid naasten te betrekken.
Exclusiecriteria waren: A. psychotische kenmerken, B. voorliggende verslavingsproblemen, C. zeer ernstige verwaarlozing en/of D. acuut of zeer hoog risico op suïcide. Erkende verwijzers konden patiënten aanmelden voor deze behandeling. Na intake werd bepaald of het behandelprogramma inderdaad passend was.
Criteria voor inclusie in de huidige studie waren: 1. deelname aan minimaal 8 van de 12 dagen behandeling en 2. minimaal 1 meting op de Beck Depression Inventory (BDI-II-NL-R) of Symptom Questionnaire 48 (SQ-48).
Procedure
Voormalige patiënten werden per post en indien nodig telefonisch of per e-mail geïnformeerd over het onderzoek en aan hen werd gevraagd een informed-consentformulier te ondertekenen. Na informed consent vulden de eerste auteur (CHH) en een verpleegkundige op basis van de aanmeld- en intakegegevens uit de dossiers de Dutch Measure for quantification of Treatment Resistance in Depression (DM-TRD) in, zonder kennis van de uitkomstmaten op het moment van beoordelen. Routine outcome monitoring(ROM)-data werden uit de dossiers opgehaald, gepseudonimiseerd, samengevoegd en geanalyseerd.
Ethiek
Het onderzoeksprotocol werd vooraf getoetst en goedgekeurd door de ethische commissie van Eleos en het onderzoek op basis van regulier verzamelde gegevens werd niet WMO-plichtig verklaard.
Meetmomenten en meetinstrumenten
Voor de uitkomstmaten maakten we gebruik van ROM-data. De meetmomenten kozen we als volgt ten opzichte van de start van de behandeling:
T0: bij de start (14 dagen voor tot max. 2 dagen na de start). We kozen de meting het dichtst bij de introductiedag, 4 dagen voor de start.
T1: 2de week van de behandeling (8-12 dagen na de start). We kozen de meting het dichtst bij dag 12, rond ontslag.
T2: 1ste twee weken na behandeling (13-26 dagen na de start). We kozen de meting het dichtst bij dag 19, 1 week na ontslag.
T3: follow-up (27-92 dagen na de start). We kozen de meting het dichtst bij 8 weken na de start.
Depressieve klachten
De primaire uitkomstmaat was de mate van ervaren depressieve klachten. Binnen de ROM was de BDI-II-NL-R afgenomen.17,18 Deze BDI bestaat uit 21 items (antwoordschaal 0-3, bereik: 0-63) die ernst van verschillende depressieve klachten meet op vier gebieden: somatische, affectieve, vegetatieve en cognitieve klachten, overeenkomend met de DSM-5-criteria. De totaalscore kan worden ingedeeld als geen tot beperkte (< 13), lichte (14-19), matige (20-28) en ernstige depressieve klachten (> 29).18
Psychische klachten en vitaliteit
De mate van psychische klachten (depressieve en andere) en de mate van vitaliteit werden binnen de ROM gemeten met de SQ-48.19 De totaalscore wordt berekend op basis van 37 items (antwoordschaal 0-4, bereik: 0-148). De subschaal vitaliteitscore meet zin, interesse en optimisme op basis van de 6 items (bereik: 0-24). Andere subschalen zijn gegeneraliseerde angst, depressie, somatische klachten, sociale fobie, agorafobie, agressie en cognitieve klachten.
Therapieresistentie
De DM-TRD werd retrospectief ingevuld zonder kennis van de behandeluitkomst. Op basis van de duur van de episode, symptoomernst, functionele beperking (score op de Global Assessment of Functioning; GAF), comorbide angst en/of persoonlijkheidsproblematiek, aanwezigheid van psychosociale stressors en behandelgeschiedenis is de mate van therapieresistentie te scoren (totaalscore 2-27, zie tabel 1 in Peeters e.a. 2016).20 De GAF-score was voor veel deelnemers niet beschikbaar in het dossier. Gezien de inclusiecriteria voor de behandeling en de wel aanwezige scores (range 30-55), kenden we aan alle deelnemers de score ‘2’ toe (GAF-score 30-60). Bij veel deelnemers was antidepressieve medicatie conform de Richtlijn Depressie reeds eerder ingezet met onvoldoende resultaat; daarin werden tijdens dit programma geen aanpassingen gedaan. Peeters e.a. vonden voor de DM-TRD eerder een goede intra- en interbeoordelaarbetrouwbaarheid en predictieve validiteit.20
Data-analyse
We gebruikten beschrijvende statistieken voor de achtergrondkenmerken en de beschrijving van uitkomstmaten bij de start. Om het effect over tijd op de depressieve klachten (BDI), totale ervaren psychische klachten (SQ-48) en mate van vitaliteit te toetsen verrichtten we drie analyses met een lineair mixed model (LMM; random intercept, ML estimation). Vanwege een verwacht niet-lineair effect over tijd (afname van het effect na het einde van de behandeling) namen we in elk model naast tijd in dagen ten opzichte van de start ook tijd2 als onafhankelijke variabele op (kwadratisch effect). Toevoeging van tijd3 voor een S-curve over tijd was niet nodig (logistisch effect).
Elk model werd gecontroleerd voor de mate van therapieresistentie, geslacht en leeftijd. De gecorrigeerde individuele scores en standaardfouten van elk model werden opgeslagen om het effect over tijd per uitkomstmaat visueel te kunnen presenteren in een grafiek. Voor het derde doel voegden we de interactie met therapieresistentie toe aan elk model (therapieresistentie*tijd en therapieresistentie*tijd2) en toetsten deze. Het significantieniveau was p < 0,05. Analyses werden uitgevoerd met SPSS-versie 26; aannames voor de LMM-analyses werden vooraf getoetst.
Resultaten
Inclusie en achtergrondgegevens
In totaal waren 107 personen in de periode mei 2019-september 2022 gestart met de behandeling (12 (11,2%) niet afgerond: 2 binnen eerste week en 10 tussen 7-11 dagen), van wie er 54 informed consent gaven. 4 van hen werden geëxcludeerd: 2 < 8 dagen en 2 zonder metingen. 50 deelnemers voldeden aan de criteria van de studie, van wie er 2 mensen 1 en 2 dagen eerder waren gestopt (4%). Er waren 14 mannelijke deelnemers (28%). De gemiddelde leeftijd was 41,4 (SD: 14,3) jaar (uitersten: 18-70 jaar). De gemiddelde mate van therapieresistente van de groep was 12,2 (SD: 1,7; uitersten: 8,5-15,5).
Beschrijvende statistiek bij de start
Bij de start van de behandeling was de gemiddelde BDI-score 34,32 (SD: 10,11; uitersten: 16-55), totale ervaren psychische klachten 79,72 (SD: 23,15; uitersten: 40-121) en mate van vitaliteit 7,98 (SD: 3,63; uitersten: 0-18). De gemiddelde score voor vrouwen ten opzichte van mannen was hoger voor depressieve klachten (M: 36,16 vs. M: 29,92) en totale ervaren psychische klachten (M: 84,97 vs. M: 67,71), maar lager voor vitaliteit (M: 7,29 vs. M: 9,50). Geen van deze verschillen was statistisch significant.
Het effect over tijd op klachten en mate van vitaliteit
De uitkomsten van LMM-analyses staan in tabel 1. Voor de mate van depressieve klachten en totale ervaren psychische klachten bleek er een significante afname over tijd te zijn. Voor vitaliteit was er geen significant effect over tijd. In figuur 1-3 tonen we de aantallen deelnemers per meetmoment (T0-T3; bereik n = 33-46) en de gecorrigeerde gemiddelde scores per meetmoment, gebaseerd op de modellen uit tabel 1. Er was een afname van de mate van depressieve (ΔT1-T0 = 4,28 en ΔT2-T0 = 5,59) en totale ervaren psychische klachten (ΔT1-T0 = 6,15). Deze effecten bleven bij follow-up behouden.
Tabel 1. LMM-analyses van de effecten over tijd op BDI totaal, SQ-48 totaal en SQ-48 vitaliteit
|
B (SE) |
95%-BI |
t-waarde |
P* |
|
|
Depressieve klachten (BDI totaal) |
||||
|
Tijd |
-0,294 (0,074) |
-0,441--0,147 |
-3,968 |
< 0,001 |
|
Tijd2 |
0,003 (0,001) |
0,001-0,005 |
-3,483 |
< 0,01 |
|
Totale ervaren psychische klachten (SQ-48 totaal) |
||||
|
Tijd |
-0,351 (0,154) |
-0,656--0,047 |
-2,285 |
< 0,05 |
|
Tijd2 |
0,004 (0,002) |
0,000-0,008 |
2,076 |
< 0,05 |
|
Mate van vitaliteit (SQ-48 vitaliteit) |
||||
|
Tijd |
-0,039 (0,028) |
-0,016-0,095 |
1,404 |
0,16 |
|
Tijd2 |
0,001 (0,000) |
-0,001-0,000 |
-1,455 |
0,15 |
Modellen waren inclusief controle voor hoofdeffect therapieresistentie, geslacht en leeftijd.
*Statistisch significante waarden zijn cursief gedrukt.
Invloed van therapieresistentie op het effect
Voor alle uitkomstmaten voegden we aan de modellen uit tabel 1 een interactieterm voor 1. therapieresistentie*tijd en 2. therapieresistentie*tijd2 toe. De resultaten hiervan staan in online tabel 2 en laten zien dat geen van deze interacties significant was.
Figuur 1. Gecorrigeerde gemiddelde scores (SE) per meetmoment op depressieve klachten
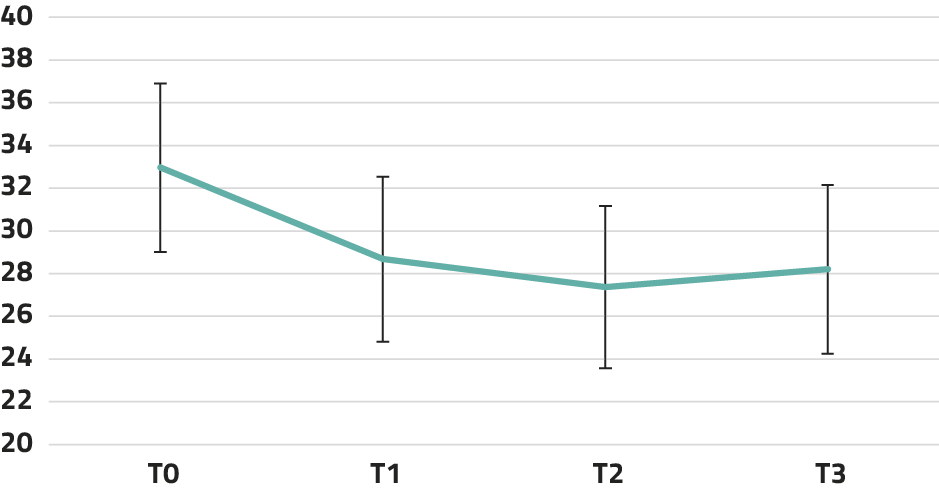
N depressieve klachten = 44 (T0), 41 (T1), 35 (T2), 33 (T3). Aantal missende waarden per meetmoment = 6-17.
Figuur 2. Gecorrigeerde gemiddelde scores (SE) per meetmoment op totale psychische klachten
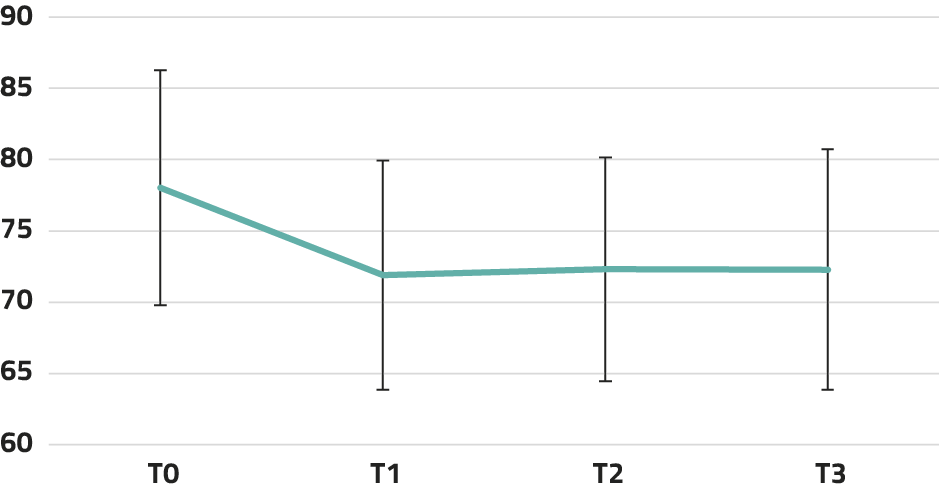
N totale psychische klachten = 46 (T0), 41 (T1), 34 (T2), 38 (T3). Aantal missende waarden per meetmoment: 4-16.
Figuur 3. Gecorrigeerde gemiddelde scores (SE) per meetmoment op vitaliteit
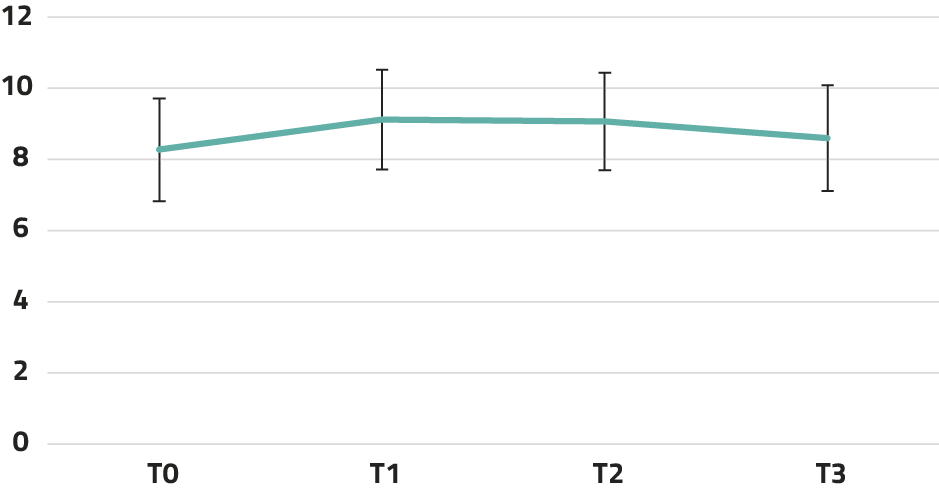
N vitaliteitscore = 45 (T0), 41 (T1), 34 (T2), 36 (T3). Aantal missende waarden per meetmoment: 5-16.
Discussie
Het doel van deze studie was te onderzoeken in welke mate een intensief programma van klinische gedragsactiverende behandeling: 1. effect heeft op de mate van de depressieve klachten en 2. effect heeft op de totale ervaren psychische klachten en vitaliteit over tijd. Ook wilden we nagaan of: 3. therapieresistentie het effect van de behandeling op deze uitkomstmaten verandert. Uit de resultaten bleek een significante afname over tijd van de depressieve klachten en totale ervaren psychische klachten, die bij follow-up lager bleef dan bij de start van behandeling. Wat betreft vitaliteit was er een kleine toename, maar deze was niet statistisch significant. Het effect van de behandeling bleek voor alle uitkomstmaten onafhankelijk van de mate van therapieresistentie (interactie tussen tijd en therapieresistentie).
Deze interventie was gericht op vermindering van depressieve klachten van patiënten voor wie eerdere ambulante behandeling onvoldoende effect had, en voor wie het doel was om de vicieuze cirkel van vermijding te doorbreken en ambulant verder te kunnen. Het programma bleek, ook bij therapieresistentie, tot een beperkte, maar significante verandering in het klachtenniveau te kunnen leiden. Dit is bereikt in twee weken intensieve behandeling, waar ambulante behandeling door de lagere frequentie van behandelmomenten (vaak wekelijks) veelal meer tijd nodig heeft voor vergelijkbare verschilscores.21 Het effect bleef goeddeels behouden bij follow-upmetingen na afronding van de behandeling. Uit eerder onderzoek is gebleken dat binnen de SQ-48 gemeten vitaliteit niet sterk gecorreleerd is met depressieschalen.22 Focus van de interventie was niet het verhogen van plezier of optimisme. Het primaire doel was het verminderen van depressieve symptomen.
De resultaten van deze observationele cohortstudie wijzen erop dat een intensief klinisch behandelprogramma gebaseerd op gedragsactivatie een effectieve interventie kan zijn voor de afname van depressieve klachten. Dit sluit aan op de eerdere gevonden effectiviteit van gedragsactivatie en het programma van Lejuez e.a. specifiek.8,9,23 Het kleine percentage uitval, ondanks de intensiteit van het programma, is vergelijkbaar met eerder onderzoek naar gedragsactivatie in een groep,10 wat een goede verdraagbaarheid suggereert. De klinische groepssetting, waarbij verpleegkundigen 24/7 beschikbaar waren en patiënten elkaar konden aanspreken en stimuleren bij vermijding (peergroupeffect) zorgde voor een hoge therapietrouw. De interventie was een multimodaal aanbod en is in zijn geheel getoetst. Meerdere levensgebieden werden betrokken, zoals het netwerk voor inzet bij herstel, aandacht voor zingeving en religiositeit/spiritualiteit, en de dagelijkse fysieke activiteiten. Deze onderdelen kunnen de effecten versterken.24-26 Op basis van deze studie kunnen we geen uitspraak doen over de bijdragen van afzonderlijke onderdelen van de interventie.
Beperkingen
Deze studie is voor zover ons bekend de eerste die in Nederland het effect van een integraal intensief behandelprogramma gebaseerd op gedragsactivatie toetst. Er is een aantal beperkingen.
Ten eerste heeft ruim 50% van de potentiële deelnemers retrospectief geen toestemming gegeven voor het gebruik van de ingevulde vragenlijsten. Dit kan hebben geleid tot selectiebias, bijvoorbeeld inclusie van patiënten met positieve(re) resultaten en/of minder therapieresistentie. Ook zijn er geen data bekend van aanmeldingen die niet leiden tot behandeldeelname.
Ten tweede leidden de beperkte groepsgrootte en missende waarden tot een grotere marge van onzekerheid – met name tijdens de follow-upmetingen – en mogelijk tot een beperkte variatie in therapieresistentie. Daardoor was er een grotere kans op een niet significant interactie-effect van therapieresistentie*tijd(2).
Ten derde waren de (behandel)context en omstandigheden tijdens de follow-upperiode niet bekend. Vanwege deze beperkingen is meer gecontroleerd onderzoek nodig om de gevonden uitkomsten te repliceren.
Conclusie
Dit onderzoek geeft een eerste voorzichtige aanwijzing dat een intensief klinisch programma voor gedragsactivatie met een multimodale opzet (betrekken van netwerk, zingeving en waarden, en lichamelijke beweging) een effectieve behandelmogelijkheid kan zijn bij ernstige depressieve klachten, waardoor patiënten uit een negatieve vicieuze cirkel worden gehaald en verdere zorg ambulant (weer) mogelijk wordt. Echter, vanwege de beperkingen is een replicatie van dit onderzoek nodig, met een focus op effecten op de langere termijn en een onderzoeksopzet met meer bewijskracht, om deze conclusie te kunnen bevestigen.
Literatuur
1 Nuijen J. Zicht op depressie: de aandoening, preventie en zorg. Themarapportage van de Staat van Volksgezondheid en Zorg. Utrecht: Trimbos-instituut; 2017. p 168.
2 Spijker J, Ruhé E, Bockting C, e.a. Multidisciplinaire richtlijn depressie (derde revisie). Richtlijn voor de diagnostiek, behandeling en begeleiding van volwassen patiënten met een depressieve stoornis. Utrecht: Trimbos-instituut; 2013.
3 Jacobson NS, Dobson KS, Truax PA, e.a. A component analysis of cognitive-behavioral treatment for depression. J Consulting Clin Psychol 1996; 64: 295-304.
4 GGZ Standaarden. Zorgstandaard Depressieve stoornissen. 2018. p. 164-5.
5 Ekers D, Webster L, Van Straten A, e.a. Behavioural activation for depression; An update of meta-analysis of effectiveness and sub group analysis. PLoS ONE 2014; 9: e100100.
6 Dimidjian S, Barrera M, Martell C, e.a. The origins and current status of behavioral activation treatments for depression. Annu Rev Clin Psychol 2011; 7: 1-38.
7 Manos RC, Kanter JW, Busch AM. A critical review of assessment strategies to measure the behavioral activation model of depression. Clin Psychol Rev 2010; 30: 547-61.
8 Ciharova M, Furukawa TA, Efthimiou O, e.a. Cognitive restructuring, behavioral activation and cognitive-behavioral therapy in the treatment of adult depression: A network meta-analysis. J Consult Clin Psychol 2021; 89: 563-74.
9 Stein AT, Carl E, Cuijpers P, e.a. Looking beyond depression: A meta-analysis of the effect of behavioral activation on depression, anxiety, and activation. Psychol Med 2021; 51: 1491-504.
10 Simmonds-Buckley M, Kellett S, Waller G. Acceptability and efficacy of group behavioral activation for depression among adults: a meta-analysis. Behav Therapy 2019; 50(5): 864-85.
11 Myhre MØ, Strømgren B, Arnesen EF, e.a. The feasibility of brief behavioural activation treatment for depression in a PICU: a systematic replication. J Psychiatr Intens Care 2018; 14: 15-23.
12 Dobson KS, Hollon SD, Schmaling KB, e.a. Randomized trial of behavioral activation, cognitive therapy, and antidepressant medication in the prevention of relapse and recurrence in major depression. J Consult Clin Psychol 2008; 76: 468-77.
13 Dimidjian S, Hollon SD, Dobson KS, e.a. Randomized trial of behavioral activation, cognitive therapy, and antidepressant medication in the acute treatment of adults with major depression. J Consult Clin Psychol 2006; 74: 658-70.
14 Richards DA, Ekers D, McMillan D, e.a. Cost and Outcome of Behavioural Activation versus Cognitive Behavioural Therapy for Depression (COBRA): a randomised, controlled, non-inferiority trial. Lancet 2016; 388: 871-80.
15 Ciharova M, Karyotaki E, Miguel C, e.a. Amount and frequency of psychotherapy as predictors of treatment outcome for adult depression: A meta-regression analysis. J Affect Disord 2024; 359: 92-9.
16 Lejuez CW, Hopko DR, Acierno R, e.a. Ten year revision of the brief behavioral activation treatment for depression: revised treatment manual. Behav Modif 2011; 35: 111-61.
17 Van der Does AJW. Handleiding bij de Nederlandstalige versie van Beck Depression Inventory – Second Edition (BDI-IINL). Amsterdam: Harcourt; 2002.
18 Beck AT, Steer RA, Brown GK. BDI-II: Beck Depression Inventory Manual-II. San Antonio: Psychological Corporation; 1996.
19 Carlier I, Schulte-Van Maaren Y, Wardenaar K, e.a. Development and validation of the 48-item Symptom Questionnaire (SQ-48) in patients with depressive, anxiety and somatoform disorders. Psychiatr Res 2012; 200: 904-10.
20 Peeters FPML, Ruhe HG, Wichers M, e.a. The Dutch Measure for quantification of Treatment Resistance in Depression (DM-TRD): an extension of the Maudsley Staging Method. J Affect Disord 2016; 205: 365-71.
21 Lemmens LHJM, Arntz A, Peeters F, e.a. Clinical effectiveness of cognitive therapy v. interpersonal psychotherapy for depression: results of a randomized controlled trial. Psychol Med 2015; 45: 2095-110.
22 Van der Heijden RA, Van Zutven K, Verhagen IPC, e.a. Psychometric properties of the Symptom Questionnaire-48 in adults with mild intellectual disability or borderline intellectual functioning in mental health care. J Ment Health Res Intell Disab 2024; doi: 10.1080/19315864.2024.2416697.
23 Hopko DR, Lejuez CW, Lepage JP, e.a. A brief behavioral activation treatment for depression: a randomized pilot trial within an inpatient psychiatric hospital. Behav Modif 2003; 27: 458-69.
24 Tjaden C, Mulder CL, Den Hollander W, e.a. Effectiveness of resource groups for improving empowerment, quality of life, and functioning of people with severe mental illness: a randomized clinical trial. JAMA Psychiatry 2021; 78: 1309.
25 Van Nieuw Amerongen-Meeuse JC, Schaap-Jonker H, Anbeek C, e.a. Religious/spiritual care needs and treatment alliance among clinical mental health patients. J Psychiatr Ment Health Nurs 2021; 28: 370-83.
26 Szuhany KL, Otto MW. Efficacy evaluation of exercise as an augmentation strategy to brief behavioral activation treatment for depression: a randomized pilot trial. Cogn Behav Therapy 2020; 49: 228-41.
Noot
Ria Mulder, Nelly Verheuvel en overige collega’s van Eleos ‘de fontein’ leverden een actieve bijdrage aan de dataverzameling.
Auteurs
Christina Hennipman-Herweijer, verpleegkundige, verplegingswetenschapper en beleidsadviseur kwaliteit, Eleos ‘de fontein’, Bosch en Duin; onderzoeker, UMC Utrecht en Kennisinstituut christelijke ggz, Eleos/De Hoop, Hoevelaken.
Cis Vrijmoeth, onderzoeker, Kennisinstituut christelijke ggz, Eleos/De Hoop, Hoevelaken, docent Klinische psychologie, Universiteit Utrecht.
Lolke Bergsma, verpleegkundig specialist, Eleos, Ede.
Henricus Ruhé, psychiater en hoofdonderzoeker, Radboudumc en Donders Institute for Brain, Cognition and Behavior, Radboud Universiteit, Nijmegen.
Bart van den Brink, psychiater en hoofd behandelzaken, GGz Centraal, Amersfoort; onderzoeker, Kennisinstituut christelijke ggz, Eleos/De Hoop, Hoevelaken; universitair docent, Theologische Universiteit Apeldoorn.
Correspondentie
Dr. Bart van den Brink (b.vandenbrink@ggzcentraal.nl).
Geen strijdige belangen gemeld.
Het artikel werd voor publicatie geaccepteerd op 9-1-2025.
Citeren
Tijdschr Psychiatr. 2025;67(4):220-224
