Augmentatie met liothyronine bij depressie
Achtergrond In de vierde revisie van de Multidisciplinaire richtlijn Depressie raadt men liothyronine(T3)-augmentatie aan een selectieve serotonineheropnameremmer (SSRI) aan als derde behandelingsstap bij matig ernstige en ernstige depressie. Deze aanbeveling staat in dezelfde behandelstap als augmentatie met lithium en atypische antipsychotica. De richtlijn verwijst naar twee netwerkmeta-analyses ter onderbouwing van effectiviteit.
Doel Het beoordelen van het bewijs voor T3-augmentatie aan SSRI’s bij depressie.
Methode We voerden een zoekopdracht uit in PubMed en Cochrane naar gecontroleerde studies over T3-augmentatie aan een SSRI.
Resultaten Zeven studies werden geïncludeerd, waarvan drie gericht op augmentatie en vier op co-initiatie. Van de augmentatiestudies was er slechts één placebogecontroleerd en deze toonde geen effectiviteit van T3 aan. De andere twee waren actief gecontroleerde studies: één open-labelstudie liet een trend richting betere effectiviteit van T3 t.o.v. lithium zien. In de andere studie specificeerde men niet of T3 of T4 werd gebruikt (de gebruikte dosis wees op T4); deze studie toonde een vergelijkbare effectiviteit als andere augmentatiestrategieën. Co-initiatie van T3 met SSRI’s werd onderzocht in vier studies. De resultaten waren uiteenlopend, variërend van betere uitkomsten met T3 tot geen verschil of zelfs een trend naar slechtere uitkomsten.
Conclusie De effectiviteit van T3-augmentatie bij SSRI’s is grotendeels gebaseerd op studies met actieve controlegroepen en deze effectiviteit is nog onvoldoende vastgesteld. Er is dringend behoefte aan een langdurige, placebogecontroleerde studie naar T3-augmentatie aan SSRI’s.
Hoewel antidepressiva effectief zijn bij de behandeling van depressieve stoornissen, blijft non-respons een veelvoorkomend klinisch probleem. De Multidisciplinaire richtlijn Depressie bevat specifieke aanbevelingen over strategieën bij non-respons binnen de geestelijke gezondheidszorg. Op 23 mei 2024 werd de vierde revisie van deze richtlijn gepubliceerd. Een opvallende wijziging ten opzichte van de versie uit 2013 is de herziene plaatsbepaling van liothyronine (T3), de actieve vorm van schildklierhormoon, in de behandeling van depressie. In de derde revisie van de richtlijn kwam augmentatie met liothyronine pas in aanmerking na lithiumadditie of een klassieke mono-amineoxidase(MAO)-remmer. De richtlijnwerkgroep stelde dat T3 alleen overwogen moest worden bij non-respons op antidepressiva wanneer andere opties, zoals lithiumadditie en een klassieke MAO-remmer, niet (meer) in aanmerking komen. In de nieuwste revisie is deze aanbeveling vervallen.
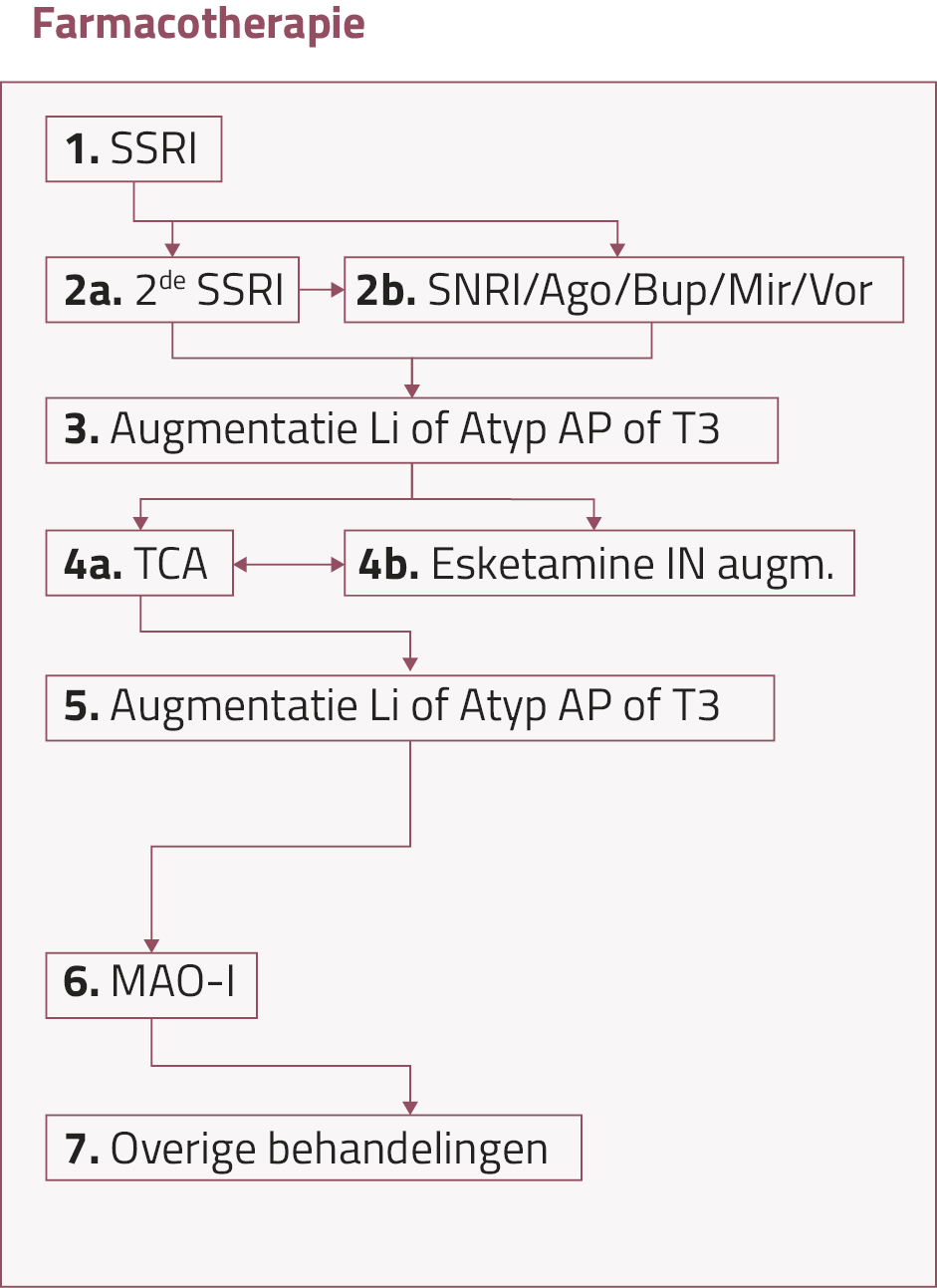
In de herziening van 2024 wordt augmentatie met T3 aan selectieve serotonineheropnameremmers (SSRI’s), serotonine-noradrenalineheropnameremmers (SNRI’s), agomelatine, bupropion, mirtazapine of vortioxetine aanbevolen als derde behandelstap bij matig ernstige en ernstige depressie. Deze aanbeveling maakt deel uit van dezelfde behandelstap als augmentatie met lithium en atypische antipsychotica.1 Ondanks deze opname in het behandelalgoritme wordt T3-augmentatie in Nederland nog relatief weinig toegepast, mogelijk vanwege de wisselende effectiviteit in klinische studies, de beperkte bekendheid met deze optie in de praktijk en het ontbreken van advies rondom de dosering.
De klinische interesse in T3 hangt deels samen met epidemiologische bevindingen over de relatie tussen schildklierfunctie en depressie. Er is een sterke en al lang erkende relatie tussen schildklierfunctie en het risico op depressie, waarbij zowel hypo- als hyperthyreoïdie geassocieerd zijn met verhoogd risico op het ontstaan van depressie. In een meta-analyse van 25 studies met 348.014 deelnemers vond men een associatie tussen hypothyreoïdie en de incidentie van depressie, met een sterkere relatie bij manifeste hypothyreoïdie dan bij subklinische vormen.2 Voor hyperthyreoïdie werd in een analyse van 15 studies met 239.608 deelnemers eveneens een significante associatie gevonden, die ook hier sterker was bij manifeste hyperthyreoïdie dan bij subklinische.3 Zelfs binnen de referentiewaarden voor schildklierfunctie is er een verband met depressie gevonden; bij 6383 deelnemers aan de Rotterdam-studie bleek een U-vormige relatie van thyreoïdstimulerend hormoon (TSH) en FT4 met de incidentie van depressie, zij het met beperkte effectgroottes.4
Het concept van T3-augmentatie bij depressie ontstond in de vorige eeuw, toen onderzoekers zochten naar alternatieve strategieën om de respons op antidepressiva te verbeteren. Het veronderstelde werkingsmechanisme van T3 bij depressie berust zowel op genregulatie als op modulatie van neurotransmittersystemen. T3 stimuleert vermoedelijk de expressie van neurotrofe factoren zoals brain-derived neurotrophic factor en corticotropin-releasing factor.5 Daarnaast moduleert T3 het serotonerge systeem via desensitisatie van autoregulatoire serotonine 1A- en serotonine 1B-receptoren, wat leidt tot verhoogde serotonine-afgifte.5
De klinische interesse in T3-augmentatie leidde al vroeg tot systematische evaluaties van de effectiviteit. Na meerdere studies volgde een meta-analyse door Aronson e.a. (1996), waarin zij acht studies met in totaal 292 patiënten includeerden. De primaire uitkomstmaat was respons, gedefinieerd als een reductie van meer dan 50% in de score op de Hamilton Rating Scale for Depression (HRSD). T3-augmentatie aan tricyclische antidepressiva (TCA’s) bleek significant effectiever dan placebo (OR: 2,09; 95%-BI: 1,31-3,32). Dit effect verdween echter bij analyse van uitsluitend gerandomiseerde en geblindeerde studies (OR: 1,53; 95%-BI: 0,70-3,35).6 Later onderzochten Altschuler e.a. het effect van T3 op de snelheid van respons bij TCA-gebruik. T3 versnelde de respons significant, maar er werd niet onderzocht of het uiteindelijke responspercentage hoger was bij T3-augmentatie dan bij TCA-monotherapie.7
De herziene richtlijn depressie baseert haar aanbeveling voornamelijk op twee netwerkmeta-analyses waarin men meerdere augmentatiestrategieën vergelijkt. Beide netwerkmeta-analyses hadden als primaire uitkomst een > 50% reductie in depressiescores ten opzichte van baseline en in beide includeerde men studies die T3-augmentatie aan zowel TCA’s als SSRI’s onderzochten. Zhoe e.a. includeerden in hun netwerkmeta-analyse 48 studies en zij onderzochten de effectiviteit van 11 verschillende augmentatiestrategieën. Zij vonden dat T3 effectiever was dan placebo (OR: 1,84; 95%-BI: 1,06-3,56). Nuñez e.a. namen in hun netwerkmeta-analyse 65 studies op en onderzochten de effectiviteit van 19 verschillende augmentatiestrategieën.8 Zij vonden dat T3 effectiever was dan placebo (relatief risico: 1,90; 95%-BI: 1,16-3,11), met het hoogste relatieve risico van alle augmentatiestrategieën.
In deze netwerkmeta-analyses maakte men geen onderscheid tussen augmentatie aan TCA’s of SSRI’s. Vanwege het verschil in werkingsmechanisme tussen TCA’s en SSRI’s is het onzeker in hoeverre de effecten van T3-augmentatie bij TCA’s te extrapoleren zijn naar SSRI’s. Daarnaast is de effectiviteit van augmentatie aan SSRI’s ook klinisch relevanter aangezien TCA’s in de herziene richtlijn pas in stap 4 zijn opgenomen.
In dit artikel bespreken we welke studies gedaan zijn met T3-augmentatie aan SSRI’s, evalueren we in hoeverre de prominente plaats van T3-augmentatie in het behandelalgoritme gefundeerd is, en formuleren we aanbevelingen voor toekomstig onderzoek.
Figuur 1. Algoritme voor farmacotherapie bij matig ernstige en ernstige depressie, overgenomen uit de vierde revisie van de Multidisciplinaire richtlijn Depressie
Methode
We voerden een literatuuronderzoek uit in december 2024 naar peer-reviewed studies die informatie verschaffen over de werkzaamheid van T3 bij volwassen patiënten met een depressieve stoornis. De literatuurstudie werd uitgevoerd met Cochrane en PubMed, de belangrijkste databanken voor evidence-based medicine.
De literatuurstudie werd uitgevoerd aan de hand van de volgende zoekstring op PubMed: ((‘Triiodothyronine’[MeSH] OR T3 OR liothyronine OR ‘thyroid hormone’) AND (‘Depression’[MeSH] OR ‘Depressive Disorder, Major’ [MeSH] OR depression OR MDD) AND (‘Randomized Controlled Trial’ [Publication Type] OR ‘Controlled Clinical Trial’ [Publication Type] OR ‘controlled trial’ OR ‘randomized controlled trial’ OR RCT)) AND humans [MeSH Terms] AND adult [MeSH Terms].
In de Cochrane Library werd de volgende zoekstring gebruikt:
(‘triiodothyronine’ OR T3 OR liothyronine) AND (‘depression’ OR ‘major depressive disorder’ OR MDD) AND ‘randomized controlled trial’. De review was niet a priori geregistreerd.
Alle artikelen werden gescreend op titel door beide auteurs. Na het verwijderen van irrelevante artikelen en duplicaten werden de overgebleven artikelen gedownload of opgevraagd en beoordeelden we per artikel of het aan de inclusiecriteria voldeed. We includeerden studies indien: 1. het een gerandomiseerde en gecontroleerde klinische trial (actieve controle of placebocontrole) betrof, 2. één van de behandelarmen T3-therapie betrof, 3. de patiëntenpopulatie bestond uit volwassen patiënten met depressie en 4. er gelijktijdig behandeling met een SSRI, SNRI, agomelatine, bupropion, mirtazapine of vortioxetine plaatsvond. Studies werden geëxcludeerd indien er sprake was van een depressie met psychotische kenmerken, of van een bipolaire stoornis.
We groepeerden artikelen op basis van augmentatie bij matig ernstige en ernstige depressie, danwel co-initiatie van T3 met een SSRI als eerstelijnstherapie. De uitkomstvariabelen in de studies betroffen voornamelijk respons, gedefinieerd als 50% reductie in symptoomscore, dan wel remissie, gedefinieerd als een score gelijk aan of lager dan 7 punten op de symptoomscore. Het risico op bias in de studies onderzochten we met de ‘Risk of Bias 2 tool’ van Cochrane.
Resultaten
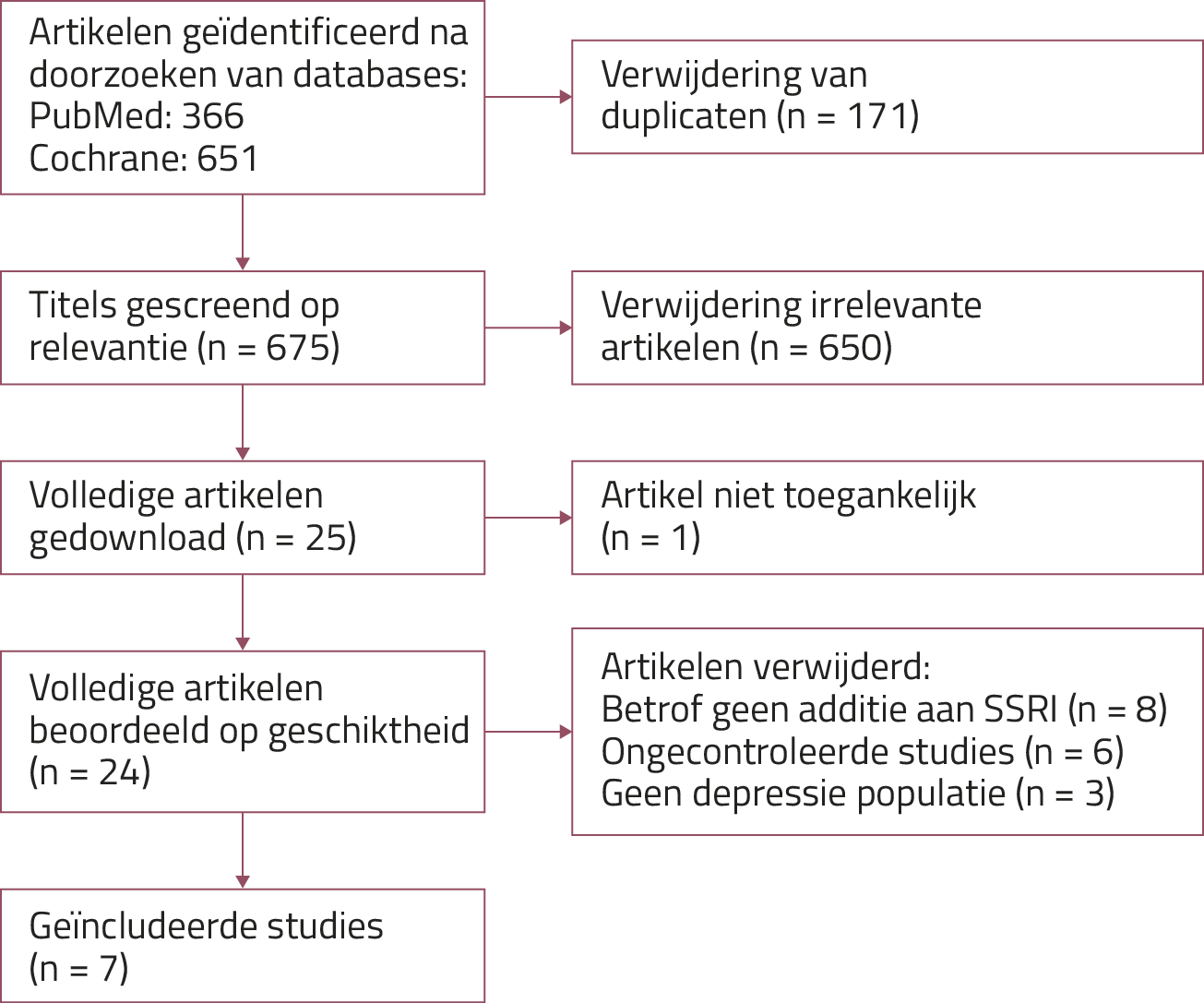
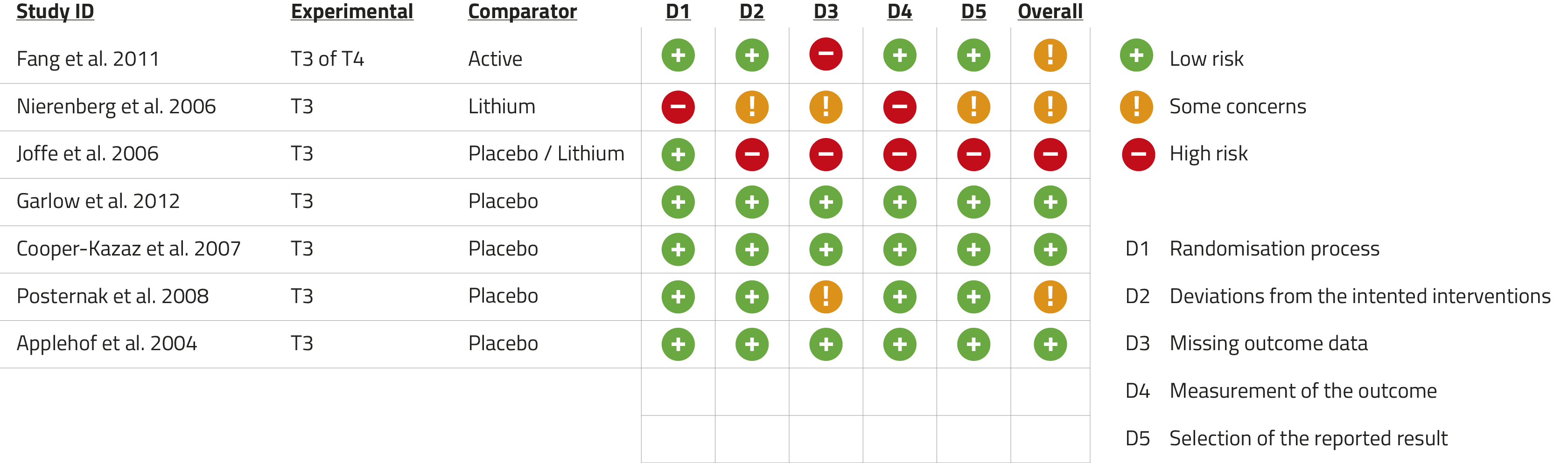
We includeerden in totaal 7 studies; zie figuur 2 voor het stroomdiagram. Van deze 7 studies ging het bij 3 om augmentatie aan een reeds bestaand antidepressivum en bij 4 om co-initiatie. De Risk of Bias-analyse toonde een hoog risico op bias bij de 3 augmentatiestudies en over het algemeen een laag risico bij de 4 co-initiatiestudies (zie figuur 3). Zes studies waren dubbelblind, de STAR*D-studie was open label.9 Vijf studies hadden een placebogroep meegenomen. De gebruikte T3-dosering varieerde van 25 tot 50 µg per dag in alle studies. In één van de studies werd enkel gesproken over schildklierhormoon, maar de gebruikte dosering van 80 mg per dag impliceert dat T4 en niet T3 als interventie was gebruikt.10
Figuur 2. Stroomschema volgens de PRISMA 2020-systematiek
Figuur 3. Beoordeling van het risico op bias volgens de Cochrane Reviews Risk of Bias tool v2
Een overzicht van de karakteristieken, methoden en uitkomsten van de individuele studies is opgenomen in tabel 1.
Van de 3 studies naar T3 in de augmentatiesetting,9-11 vonden Fang e.a. dat een hogere mate van remissie werd bereikt met schildklierhormoon (37,5%) in vergelijking met risperidon (26,7%) en buspiridon (32,6%).10 De remissie was echter lager dan bij valproïnezuur (48,7%) en trazodon (42,6%), hoewel er geen significant verschil was tussen de vijf behandelgroepen (p = 0,26).10
Nierenberg e.a. namen een numeriek hogere mate van remissie waar in de T3-groep (24,7%) vergeleken met de lithiumgroep (15,9%), maar dit verschil was niet statistisch significant (p = 0,42).9 Joffe e.a. definieerden geen primaire uitkomstmaat, maar presenteerden een staafdiagram dat geen verschil liet zien tussen T3, lithium, T3 en lithium, en placebo na twee weken behandeling.11
Van de 4 studies naar co-initiatie van T3 en een SSRI,12-15 rapporteerden Garlow e.a. een respons bij 62% van de patiënten in de T3-groep en 65% in de placebogroep, maar dit verschil was statistisch niet significant (p > 0,05).12 Cooper-Kazaz e.a. vonden een respons van 70% in de T3-groep, significant hoger dan de 50% in de placebogroep (p = 0,02).13 Posternak e.a. bereikten een respons bij 61% van de patiënten in de T3-groep en 52% in de placebogroep, zonder significant verschil (p = 0,52).14 Appelhof e.a. vonden dat de mate van respons gelijk was in de T3- en de placebogroep (46%; p = 0,99).15
Tabel 1. Overzicht van resultaten literatuuronderzoek
|
Eerste auteur (jaar) |
Populatie |
Opzet |
Interventie |
Controlegroep |
Duur |
Primaire uitkomst |
Resultaten |
|---|---|---|---|---|---|---|---|
|
Augmentatie aan SSRI/SNRI |
|||||||
|
Fang (2011)10 |
225 patiënten met therapieresistente depressie die paroxetine 20 mg/dag gebruikten |
Gerandomiseerd, dubbelblind, actieve controlebehandeling |
Schildklierhormoon (80 mg/dag, ongespecificeerd welk hormoon) |
Risperidon, valproïnezuur, trazodon en buspiron |
8 weken |
Remissie (HRSD < 7) |
Remissie bij 37,5% met schildklierhormoon, 26,7% met risperidon, 48,7% met valproïnezuur, 32,6% met buspiron en 42,6% met trazodon (p = 0,26 voor verschil tussen de 5 groepen). |
|
Nierenberg (2006)9 |
142 patiënten die geen remissie hadden bereikt bij initiële prospectieve behandeling met SSRI en overstap of augmentatie; allen gebruikten reeds een antidepressivum |
Gerandomiseerd, open label, actieve controlebehandeling |
T3 (25 µg/dag, verhoogd naar 50 µg/dag in week 2) |
Lithium (gestart met 450 mg/dag, verhoogd naar 900 mg/dag in week 3) |
Tot 14 weken |
Remissie (HRSD < 7) |
Remissie bij 24,7% van de patiënten in de T3-groep en 15,9% in de lithiumgroep (p = 0,42). |
|
Joffe (2006)11 |
36 patiënten met depressie die niet voldoende reageerden op ten minste 1 antidepressivum |
Gerandomiseerd, dubbelblind, placebo en actieve controlebehandeling |
T3 (37,5 µg/dag) met of zonder lithium (600 mg/dag) |
Placebo of lithium (600 mg/dag) |
2 weken |
Niet gedefinieerd |
Bij ANCOVA-analyse geen verschil in HRSD-scores tussen de groepen. Respons of remissie niet genoemd. |
|
Co-initiatie met SSRI |
|||||||
|
Garlow (2012)12 |
153 patiënten met depressie zonder therapie bij aanvang |
Gerandomiseerd, dubbelblind, placebogecontroleerd |
T3 (25 µg/dag in week 1, 50 µg/dag vanaf week 2) en sertraline (tot max. 200 mg/dag) |
Placebo en sertraline (verhoogd tot max. 200 mg/dag) |
8 weken |
Respons (50% reductie en totale score < 15 op 21 item-HRSD) |
Respons bij 62% van de patiënten in de T3-groep en 65% in de placebogroep (p > 0,05). |
|
Cooper-Kazaz (2007)13 |
124 patiënten met depressie zonder therapie bij aanvang |
Gerandomiseerd, dubbelblind, placebogecontroleerd |
T3 (25 µg/dag in week 1, 50 µg/dag vanaf week 2) en sertraline (tot max. 100 mg/dag) |
Placebo en sertraline (verhoogd tot max. 100 mg/dag). |
8 weken |
Respons (50% reductie op 21 item-HRSD) |
Respons bij 70% van de patiënten in de T3-groep en 50% in de placebogroep (oddsratio: 2,93; 95%-BI: 1,23-7,35; p = 0,02). |
|
Posternak (2008)14 |
50 patiënten met een depressie, zonder restricties op de selectie van antidepressiva (meestal SSRI’s); 65% van hen net gestart met antidepressivum |
Gerandomiseerd, dubbelblind, placebogecontroleerd |
T3 (25 μg/dag) |
Placebo |
6 weken |
Respons (50% reductie in MADRS) |
Respons bij 61% van de patiënten in de T3-groep en 52% in de placebogroep (oddsratio: 1,44; 95%-BI: 0,46-4,46; p = 0,52). |
|
Appelhof (2004)15 |
106 patiënten met een depressie |
Gerandomiseerd, dubbelblind, placebogecontroleerd |
T3 (25 µg of 50 µg/dag), en paroxetine 30 mg/dag |
Placebo en paroxetine 30 mg/dag |
8 weken |
Respons (50% reductie in MADRS) |
Respons bij 46% van de patiënten in zowel de lage- en hogedosis-T3-groep als placebogroep (p = 0,99). |
ANCOVA: analysis of covariance; HRSD: Hamilton Rating Scale for Depression; MADRS: Montgomery–Asberg Depression Rating Scale.
Discussie
Ondanks het opnemen van T3-augmentatie aan een SSRI in de richtlijn blijft het bewijs voor de effectiviteit ervan onvoldoende overtuigend. Van de 7 geïncludeerde studies waren er slechts 3 gericht op augmentatie bij onvoldoende effect op initiële therapie, en slechts 1 daarvan had een placebogroep. Naast de inconsistente resultaten vertoonden alle 3 de studies een hoog risico op bias, wat resulteert in een zeer laag kwaliteitsniveau van het bewijs volgens het GRADE-systeem. Hierdoor is het momenteel niet mogelijk om vast te stellen dat T3-augmentatie aan een SSRI bewezen effectief is als derde behandelingsoptie in het behandelalgoritme voor depressie.
Methodologie van gebruikte netwerkmeta-analyses
Om het bewijs uit de richtlijn beter te begrijpen, is het belangrijk de methodologie van deze meta-analyses te beschouwen. De richtlijn verwijst naar de twee al genoemde netwerkmeta-analyses.8,16 In een netwerkmeta-analyse combineert men directe vergelijkingen (zoals interventie A versus interventie B in dezelfde studies) met indirecte vergelijkingen (zoals interventie A versus interventie B, afgeleid via een gemeenschappelijke comparator, bijvoorbeeld interventie C). Hierdoor kan men meerdere interventies vergelijken, zelfs als deze niet direct tegen elkaar zijn onderzocht.
In de netwerkmeta-analyse van Zhou e.a. werd een oddsratio (OR) van 1,84 (95%-BI: 1,06-3,56) gevonden voor schildklierhormonen ten opzichte van placebo. Naast schildklierhormonen werden lithium, aripiprazol en quetiapine als significant effectiever dan placebo geïdentificeerd. Opvallend is dat in deze traditionele paarsgewijze meta-analyse, waarbij alleen directe vergelijkingen worden meegenomen, het effect van schildklierhormonen niet significant was ten opzichte van placebo (OR 1,55; 95%-BI: 0,55-4,36). Lithium, aripiprazol en quetiapine bleven daarentegen wel significant effectiever dan placebo in de paarsgewijze meta-analyse.16 In een andere paarsgewijze meta-analyse, gericht op T3-augmentatie aan antidepressiva (zowel TCA’s als SSRI’s), vond men ook geen significante verbetering in de gepoolde T3-groep ten opzichte van placebo.17
De positieve resultaten van de netwerkmeta-analyses zijn grotendeels bepaald door studies met actieve comparatoren, met name de STAR*D-trial waarin T3 werd vergeleken met lithium.9 Beperkingen van STAR*D zijn het gebrek aan therapeutische geneesmiddelmonitoring in de lithiumgroep en het gegeven dat respons uitsluitend werd gemeten met de Quick Inventory of Depressive Symptomatology Self-Report en niet met de HRSD-schaal, zoals in andere T3-studies.9,18 De open-labelopzet en het ontbreken van een placebogroep kunnen hebben geleid tot overschatting van het effect, zoals ook Rutherford e.a. in een meta-analyse van 90 antidepressieve trials aantoonden. Hierin waren de kansen op respons (OR 1,79; 95%-BI: 1,45-2,17) en remissie (OR 1,53; 95%-BI: 1,11-2,11) significant hoger in studies met een actieve comparator dan in placebogecontroleerde studies.19 Vermoedelijk weten patiënten in actieve studies dat ze een werkzame behandeling ontvangen, wat hun verwachtingen en vertrouwen verhoogt. Hierdoor is onduidelijk hoe geschikt netwerkmeta-analyse is voor het evalueren van T3-augmentatie bij SSRI’s. Er is immers slechts één placebogecontroleerde studie gedaan, die bovendien beperkt was qua duur en methodologie.11
Behalve naar augmentatie bij matig ernstige en ernstige depressie keken we ook naar het gelijktijdig starten van T3 met een antidepressivum (co-initiatie). In vier studies werd behandeling met een SSRI en T3 vergeleken met SSRI en een placebo.12,14,15 Een meta-analyse van deze vier studies, met in totaal 444 patiënten, toonde hogere respons en remissie voor T3-co-initiatie ten opzichte van co-initiatie met placebo na 6 tot 8 weken behandeling, maar het effect was niet significant; de gepoolde risicoratio’s waren 1,12 (95%-BI: 0,85-1,46) voor respons en 1,06 (95%-BI: 0,78-1,45) voor remissie.20
Binnen deze co-initiatiestudies zijn er aanwijzingen dat specifieke subgroepen mogelijk wél baat hebben bij T3. In een studie bereikten patiënten met lagere T3-waarden bij aanvang significant vaker remissie op sertraline gecombineerd met T3 dan patiënten met hogere T3-waarden.21 In een genetische analyse bij patiënten die sertraline gecombineerd met T3 ontvingen, hadden dragers van het DIO1-C785T-polymorfisme, dat geassocieerd is met verminderde conversie van T4 naar T3, een grotere afname in depressiescores na behandeling met sertraline en T3.21 Deze gegevens suggereren dat zowel biochemische als genetische factoren de respons op T3-augmentatie kunnen beïnvloeden.
Onderbouwing van andere augmentatiestrategieën
Om T3 in perspectief te plaatsen, is het nuttig kort te reflecteren op de onderbouwing van andere augmentatiestrategieën. Hoewel een gedetailleerde beschrijving van studies bij andere augmentatiestrategieën buiten de scope van dit artikel valt, zijn er voor de antipsychotica quetiapine en aripiprazol wel grote placebogecontroleerde studies gepubliceerd waarin ze effectiever waren dan placebo bij augmentatie aan een SSRI.22,23 Voor lithium geldt net als voor T3 dat in het gros van de placebogecontroleerde studies men augmentatie aan TCA’s heeft onderzocht. Desondanks zijn er enkele placebogecontroleerde studies met augmentatie aan SSRI’s die gepoold een vergelijkbaar effect toonden ten opzichte van de augmentatie aan TCA’s.24 Het is tevens van belang dat T3 volledig offlabel is bij depressie, terwijl lithium wel een profylaxe-indicatie heeft voor unipolaire depressie en quetiapine een add-onindicatie heeft bij depressie die onvoldoende reageert op monotherapie.
Het beperkte aantal grote, langdurige placebogecontroleerde studies naar T3-augmentatie bij SSRI’s roept vragen op over de onderliggende oorzaken. Een mogelijke verklaring is het positieve, maar beperkte bewijs uit kleinere studies met T3 als augmentatie bij TCA’s. Aangezien TCA’s lange tijd de standaardbehandeling voor depressie waren, werd verondersteld dat T3 ook effectief zou zijn bij SSRI’s, wat wellicht heeft bijgedragen aan de keuze voor actieve controle in plaats van placebocontrole in twee van de drie studies. Daarnaast ontbreekt, door het verlopen patent van T3, de commerciële stimulans voor farmaceutische bedrijven om grootschalige studies te financieren. Ten slotte is de focus in de klinische praktijk meer gericht op psychofarmaca, zoals lithium en antipsychotica, waar psychiaters meer ervaring mee hebben.
Vereisten voor toekomstig onderzoek naar T3-augmentatie
Om de effectiviteit van T3-augmentatie aan een SSRI bij depressie beter te onderbouwen, is toekomstig onderzoek wenselijk. De Guideline on clinical investigation of medicinal products in the treatment of depression van de European Medicine Agency geeft aan dat vanwege de variabele behandeleffecten bij depressie er ten minste twee placebogecontroleerde studies van circa 6 weken gedaan dienen te worden om effectiviteit aan te tonen op de korte termijn.25 Daarnaast dient een langere studie uitgevoerd te worden om behoud van effect aan te tonen. Bij een dergelijk onderzoeksdesign worden stabiele responders eerst geïdentificeerd. Daarna worden zij gerandomiseerd naar voortzetting van het onderzochte middel of naar placebo, waarna men het risico op terugval onderzoekt over een periode van ongeveer zes maanden.
Een volledig klinisch onderzoeksprogramma vanuit de industrie is echter onwaarschijnlijk gezien het ontbreken van patent op T3 en derhalve ook van een commerciële stimulans voor forse investeringen in studies. Een door onderzoekers geïnitieerde studie is beter haalbaar. In zo’n studie zouden patiënten die onvoldoende reageerden op twee SSRI’s gerandomiseerd kunnen worden naar hun huidige SSRI plus T3 of plus placebo. De studie zou acht weken kunnen duren. De primaire uitkomstmaat zou respons kunnen zijn. Secundaire uitkomstmaten kunnen remissie, partiële respons en verandering in depressiescore zijn. De metingen bij aanvang van een studie zouden idealiter uitgebreid moeten zijn. Bijvoorbeeld met T3, T4, TSH en genetische varianten van deiodinase-enzymen. Deze gegevens kunnen helpen om factoren te identificeren die het effect van T3 voorspellen.
Beperkingen
De beperkingen van dit overzichtsartikel betreffen het ontbreken van preregistratie, het niet strikt hanteren van de PRISMA-richtlijnen, het niet systematisch toepassen van het GRADE-instrument, en het gebruik van uitsluitend de databanken PubMed en Cochrane.
Conclusie
We concluderen dat het bewijs voor effectiviteit van T3-augmentatie aan SSRI’s beperkt is. De meeste gegevens zijn indirect en afkomstig uit netwerkmeta-analyses. In traditionele paarsgewijze meta-analyses werd geen significant effect gevonden, hoewel de puntschattingen positief waren. Al vijftien jaar is er geen placebogecontroleerde studie naar T3-augmentatie meer uitgevoerd. Er is dringend behoefte aan een nieuwe studie waarin men de effectiviteit van T3-augmentatie onderzoekt en differentieert welke patiënten hier het meest van profiteren.
Literatuur
1 Werkgroep Depressie op initiatief van de Nederlandse Vereniging voor Psychiatrie: Multidisciplinaire richtlijn Depressie 4e revisie. Richtlijnendatabase van de Federatie Medisch Specialisten maart 2024.
2 Bode H, Ivens B, Bschor T, e.a. Association of hypothyroidism and clinical depression JAMA Psychiatry 2021; 78: 1375-83.
3 Bode H, Ivens B, Bschor T, e.a. Hyperthyroidism and clinical depression: a systematic review and meta-analysis. Transl Psychiatry 2022; 12: 362.
4 Kuś A, Kjaergaard AD, Marouli E, e.a. Thyroid function and mood disorders: A Mendelian randomization study. Thyroid 2021; 31: 1171-81.
5 Lifschytz T, Segman R, Shalom G, e.a. Basic mechanisms of augmentation of antidepressant effects with thyroid hormone. Curr Drug Targets 2006; 7: 203-10.
6 Aronson R, Offman HJ, Joffe RT, e.a. Triiodothyronine augmentation in the treatment of refractory depression: A meta-analysis. Arch Gen Psychiatry 1996; 53: 842-8.
7 Altshuler LL, Bauer M, Frye MA, e.a. Does thyroid supplementation accelerate tricyclic antidepressant response? A review and meta-analysis of the literature. Am J Psychiatry 2001; 158: 1617-22.
8 Nuñez NA, Joseph B, Pahwa M, e.a. Augmentation strategies for treatment resistant major depression: A systematic review and network meta-analysis. J Affect Disord 2022; 302: 385-400.
9 Nierenberg AA, Fava M, Trivedi MH, e.a. A comparison of lithium and T3 augmentation following two failed medication treatments for depression: A STAR*D report. Am J Psychiatry 2006; 163: 1519-30.
10 Fang Y, Yuan C, Xu Y, e.a. A pilot study of the efficacy and safety of paroxetine augmented with risperidone, valproate, buspirone, trazodone, or thyroid hormone in adult Chinese patients with treatment-resistant major depression. J Clin Psychopharmacol 2011; 31 :638-42.
11 Joffe RT, Sokolov STH, Levitt AJ. Lithium and triiodothyronine augmentation of antidepressants. Can J Psychiatry 2006; 51: 791-3.
12 Garlow SJ, Dunlop BW, Ninan PT, e.a. The combination of triiodothyronine (T3) and sertraline is not superior to sertraline monotherapy in the treatment of major depressive disorder. J Psychiatr Res 2012; 46: 1406-13.
13 Cooper-Kazaz R, Apter JT, Cohen R, e.a. Combined treatment with sertraline and liothyronine in major depression. Arch Gen Psychiatry 2007; 64: 679-88.
14 Posternak M, Novak S, Stern R, e.a. A pilot effectiveness study: Placebo-controlled trial of adjunctive L-triiodothyronine (T3) used to accelerate and potentiate the antidepressant response. Int J Neuropsychopharmacol 2008; 11: 15-25.
15 Appelhof BC, Brouwer JP, Van Dyck R, e.a. Triiodothyronine addition to paroxetine in the treatment of major depressive disorder. Journal of Clinical Endocrinology and Metabolism 2004; 89: 6271-6.
16 Zhou X, Ravindran A V, Qin B, e.a. Comparative efficacy, acceptability, and tolerability of augmentation agents in treatment-resistant depression: Systematic review and network meta-analysis. J Clin Psychiatry 2015; 76: e487-98.
17 Lorentzen R, Nørgaard Kjær J, Dinesen Østergaard S, e.a. Thyroid hormone treatment in the management of treatment-resistant unipolar depression: a systematic review and meta-analysis. Acta Psychiatr Scand 2020; 141: 316-26.
18 Pigott HE. The STAR*D trial: It is time to reexamine the clinical beliefs that guide the treatment of major depression. Can J Psychiatry 2015; 60: 9-13.
19 Rutherford BR, Sneed JR, Roose SP. Does study design influence outcome? – The effects of placebo control and treatment duration in antidepressant trials. Psychother Psychosom 2009; 78: 172-81.
20 Papakostas GI, Cooper-Kazaz R, Appelhof BC, e.a. Simultaneous initiation (coinitiation) of pharmacotherapy with triiodothyronine and a selective serotonin reuptake inhibitor for major depressive disorder: A quantitative synthesis of double-blind studies. Int Clin Psychopharmacol 2009; 24: 19-25.
21 Cooper-Kazaz R, van der Deure WM, Medici M, e.a. Preliminary evidence that a functional polymorphism in type 1 deiodinase is associated with enhanced potentiation of the antidepressant effect of sertraline by triiodothyronine. J Affect Disord 2009; 116: 113-6.
22 Berman RM, Fava M, Thase ME, e.a. Aripiprazole augmentation in major depressive disorder: A double-blind, placebo-controlled study in patients with inadequate response to antidepressants. CNS Spectr 2009; 14: 197-206.
23 Bauer M, Pretorius HW, Constant EL, e.a. Extended-release quetiapine as adjunct to an antidepressant in patients with major depressive disorder: Results of a randomized, placebo-controlled, double-blind study. J Clin Psychiatry 2009; 70: 540-9.
24 Nelson JC, Baumann P, Delucchi K, e.a. A systematic review and meta-analysis of lithium augmentation of tricyclic and second generation antidepressants in major depression. J Affect Disord 2014; 168: 269-75.
25 European Medicines Agency. Clinical investigation of medicinal products in the treatment of depression – Scientific guideline 2025. www.ema.europa.eu/en/clinical-investigation-medicinal-products-treatment-depression-scientific-guideline.
Auteurs
Adrian Post, postdoctoraal onderzoeker, UMC Groningen.
John Hoogeveen, psychiater, Verslavingszorg Noord Nederland, Groningen en Psychiatrie Nu en Straks, Bakkeveen.
Correspondentie
Dr. Adrian Post (a.post01@umcg.nl).
Geen strijdige belangen gemeld.
Het artikel werd voor publicatie geaccepteerd op 31-5-2025.
Citeren
Tijdschr Psychiatr. 2025;67(7):387-392
