Pseudobulbair affect in de prodromale fase van psychose: een casusbeschrijving
Lachen en huilen zijn fundamentele menselijke uitingen die een centrale rol spelen in sociale interactie en emotionele communicatie. Bij bepaalde neurologische aandoeningen of psychiatrische stoornissen kunnen deze gedragingen pathologisch worden, wat kan leiden tot aanzienlijke beperkingen in interpersoonlijk en sociaal functioneren. Wij beschrijven een patiënt die zich meldde met onbeheersbare episodes van lachen en huilen en drie weken later een psychotische episode kreeg. In dit artikel bespreken wij de epidemiologie, pathofysiologie, diagnostische overwegingen en opkomende therapeutische opties voor pathologisch lachen en huilen (pseudobulbair affect), zoals de combinatie dextromethorfan/kinidine. Er lijkt een gebrek aan informatie te bestaan over de behandeling van deze symptomen bij niet-neurologische aandoeningen, zoals psychose. We constateren dat eenduidige definities ontbreken in de literatuur en onze casus illustreert de diagnostische uitdagingen bij het onderscheiden van neurologische en psychiatrische oorzaken van pathologische affectieve uitingen.
In sociale interactie en emotionele communicatie zijn lachen en huilen fundamentele menselijke uitingen. Wanneer lach- of huilbuien niet in verhouding tot, of incongruent zijn met, de onderliggende emoties, of optreden zonder prikkel, kan dit wijzen op een neurologische aandoening of psychiatrische stoornis.1,2 Dergelijke ongepaste of ongecontroleerde lach- of huilbuien passen bij een pseudobulbair affect (PBA) en leiden tot aanzienlijke (sociale) beperkingen.2,3
De naam PBA verwijst naar de klinische gelijkenis met bulbaire stoornissen. PBA kan zich voordoen met of zonder andere pseudobulbaire tekenen, zoals dysartrie, dysfagie, spasticiteit van de gezichtsspieren of autonome symptomen. Lachbuien kunnen ook voorkomen bij epileptische insulten; in dat geval spreekt men van gelastische of dacrystische aanvallen.
Het PBA wordt traditioneel gedefinieerd als episodes van pathologisch lachen en/of huilen die secundair optreden bij een onderliggende neurologische aandoening, zoals hersenletsel, multiple sclerose (MS) of amyotrofische laterale sclerose (ALS). PBA is een secundair verschijnsel van onderliggend pathofysiologisch disfunctioneren op basis van een neurologische aandoening. De term wordt echter ook gebruikt in bredere zin om soortgelijke affectieve ontregelingen bij psychiatrische stoornissen te beschrijven, hoewel hierover geen eenduidige consensus bestaat.3,4
In dit casusverslag bespreken we een patiënt met onbeheersbare episodes van lachen en huilen die drie weken na het begin van deze symptomen een psychotische episode kreeg. We bespreken de neurologische en psychiatrische evaluatie met het opstellen van een differentiaaldiagnose en de mogelijke behandelopties.
Casusbeschrijving
Patiënt A, een 48-jarige man, meldde zich op de spoedafdeling met klachten van ongecontroleerde lach- en huilbuien. Deze waren twee weken voor aanmelding begonnen, zonder duidelijke luxerende factor. De eerste episode bestond uit een, niet te onderdrukken, acht uur durende lachbui. Enkele dagen later, tijdens een uitvaart, volgde een tweede episode, dit keer met onbedwingbare huilbuien die ongeveer twintig minuten aanhielden en vervolgens overgingen in langdurig en ongecontroleerd lachen waarbij hij de dienst moest verlaten. Hij had toen letterlijk buikpijn van het lachen. De klachten ervoer hij als beangstigend en beschamend. De episodes hielden aan, met tussendoor enkele symptoomvrije dagen. Confrontatie met familiale en werkgerelateerde spanningen bleken de aanvallen te kunnen uitlokken.
Sinds zijn adolescentie kende hij stemmingsklachten, zonder concrete aanleiding. Op 16-jarige leeftijd ondernam hij een eerste suïcidepoging. Nadien volgden nog drie pogingen tot strangulatie en meerdere intoxicaties met diverse psychiatrische opnames voor stemmingsstoornissen en alcoholmisbruik tot gevolg. Hij werd in het verleden behandeld met diazepam, venlafaxine, quetiapine en disulfiram. Voorafgaand aan opname gebruikte de patiënt nog steeds venlafaxine. Op basis van observatiegegevens tijdens de verschillende opnames werd een onderliggende cluster A-persoonlijkheidsstoornis vermoed. Gestructureerde persoonlijkheidsdiagnostiek had echter niet plaatsgevonden.
Bij observatie op de afdeling Neurologie kon geen onderliggende neurologische aandoening gevonden worden voor de klachten bij aanmelding. Bij het psychiatrisch onderzoek waren er aanvankelijk geen aanwijzingen voor hallucinaties of wanen, de patiënt rapporteerde geen gevoelens van derealisatie of depersonalisatie. Hij was in staat zijn gedachten coherent uit te drukken met een intact ziektebesef. Het kritisch vermogen en de oordeelsfunctie van de patiënt waren niet verstoord. Hij gaf aan zich gespannen en prikkelbaar te voelen.
Zijn affect was ernstig verstoord met incongruente lach- en huilbuien en versneld, excessief boos worden op medepatiënten of het verpleegkundig personeel. Hij linkte deze frustraties aan de onmacht zijn lach- en huilbuien onder controle te houden. Het verzorgend personeel ervoer de klachten als bevreemdend en bij momenten angstaanjagend.
Somatisch meldde patiënt last te hebben van dysartrie en een droge mond. In de voorgeschiedenis meldde hij enkel migraine, waarvoor hij sinds 2014 neurologisch werd gecontroleerd.
Op basis van de plots ontstane episodes van affectlabiliteit werd initieel gedacht aan een pseudobulbair affect (PBA). Psychiatrisch werd differentiaaldiagnostisch gedacht aan een psychotische stoornis, een atypische depressie of een cluster A-persoonlijkheidsstoornis.
Gedurende de derde week van de opname ontstond een geagiteerd psychotisch toestandsbeeld met paranoïde wanen en met visuele en auditieve hallucinaties. Een beschermende observatiemaatregel (BOM) was onvermijdelijk, waarna de patiënt werd overgebracht naar een gesloten afdeling van een nabijgelegen psychiatrisch ziekenhuis. Na behandeling van zijn psychotische stoornis met olanzapine 20 mg per dag, klaarde het beeld op. Na het opklaren van de psychose werd een second opinion gevraagd in een ander ziekenhuis, met herevaluatie van alle onderzoeken en ter uitsluiting van een neurologische aandoening. Ook bij deze tweede opinie werd geen neurologische aandoening vastgesteld.
Technische en diagnostische onderzoeken
Bij de aanmelding op de spoedafdeling werden een ecg en een uitgebreid bloedonderzoek verricht, die geen bijzonderheden vertoonden, met name geen aanwijzingen voor alcohol- of drugsmisbruik. Aanvullend onderzoek tijdens opname toonde normale uitslagen na een lumbaalpunctie, zonder aanwijzingen voor infectie of inflammatie. Er was een positieve screening van anti-cerebellum-antilichamen, maar verder auto-immuunonderzoek, inclusief antineuronale en auto-immune encefalitis-antilichamen, was negatief. Specifieke antistoffen ontbraken, waardoor een paraneoplastische of auto-immune cerebellaire afwijking onwaarschijnlijk werd geacht.
De uitslagen van het eeg- en brainstem auditorial evoked potential(BAEP)-onderzoek waren normaal en een MRI van de hersenen toonde wittestofletsels, zonder progressie ten opzichte van 2014.
Een FDG-PET/CT-scan toonde frontotemporaal hypometabolisme, in de frontale kwabben meer rechts dan links en meer uitgesproken anterobasaal. Aanvullende afwijkingen werden gezien posterolateraal in de rechter temporale kwab.
Om een inschatting te maken over de ernst van de klachten werd gebruikgemaakt van de Center for Neurologic Study-Lability Scale (CNS-LS). Dit is een zelfrapportageschaal met 7 items waarbij de ernst van elk item een score van 1 tot 5 krijgt. Hoe hoger de score, hoe ernstiger de klachten. De schaal wordt gebruikt bij de kwantificatie van PBA en voor de respons van de farmacologische behandeling. Onze patiënt behaalde een score van 30 op de CNS-LS, wat ruim boven de afkapwaarde van 13 lag en wees op een uitgesproken ernst van de klachten. Hoewel de schaal geen diagnostisch instrument is, ondersteunde de score het klinische vermoeden van PBA.
De Beck Depression Inventory (BDI) gaf een score van 21, passend bij matig-ernstige depressieve klachten, maar deze waren klinisch minder op de voorgrond aanwezig.
Voor de behandelvoorstellen hielden we rekening met de bevindingen uit onderzoek, observatie en anamnese. We overwogen de eerstekeuzebehandeling voor PBA met dextromethorfan/kinidine. Als alternatief dachten we op basis van de score op de BDI aan een SSRI of TCA in lage dosering. Daarnaast werd geadviseerd de huidige psychofarmaca (onder meer venlafaxine en quetiapine) te herevalueren wegens mogelijke bijdrage aan affectlabiliteit en de invloed van kinidine op het metabolisme. Niet-medicamenteuze interventies, waaronder psycho-educatie, stressmanagement en aanpassing van de werksituatie en mantelzorgbelasting, werden overwogen, maar door de korte opnameduur nog niet aangeboden.
Discussie
Methode literatuuroverzicht
Met de trefwoorden ‘pathological laughter’ and ‘laughter’ en aanvullend met ‘pathological laughter’ or ‘laughter’ and ‘psychosis’ zochten we op PubMed naar passende literatuur. Dit leverde respectievelijk 356 en 21 artikelen op. Na verwijdering van duplicaten bleven er 366 artikelen over. Selectie gebeurde op basis van relevante psychiatrische en neurologische inhoud.
De literatuurlijst werd aangevuld met een zoekopdracht naar de behandeling van pseudobulbair affect met de trefwoorden ‘pseudobulbar affect’ and ‘treatment’. Dit resulteerde in 181 artikelen waaruit we op basis van relevantie een selectie maakten.
Epidemiologie
Over de epidemiologie van PBA bij psychiatrische aandoeningen vonden we geen studies.
De schattingen van de incidentie en prevalentie van pathologisch lachen en huilen zijn vaak onnauwkeurig ten gevolge van een gebrek aan consensus over de definitie.4
Men schat de incidentie van PBA één jaar na traumatische hersenschade op 15,5%.5 Na een ischemische beroerte wordt PBA frequent gezien met een prevalentie van 11 tot 34% binnen één jaar.6 Bij multipele systeematrofie (MSA) werd pathologisch lachen en huilen vastgesteld bij respectievelijk 12,7% van alle patiënten met MSA, 12,0% van het parkinsonistische subtype (MSA-P) en 13,2% van het cerebellaire subtype (MSA-C).7 Ook bij multiple sclerose (MS) komt pathologisch lachen voor, met een geschatte frequentie van 10-29%.8 In het verloop van ALS ontstaan bij ongeveer 50% van de patiënten symptomen passend bij PBA.9 PBA is ook beschreven bij andere neurologische aandoeningen zoals alzheimerdementie en de ziekte van Parkinson.
Pathogenese van PBA
Er zijn vermoedelijk twee circuits betrokken bij de pathogenese: het vrijwillige, gedragsmatige circuit en het emotionele circuit (figuur 1).1,2,4,10
Figuur 1. Pathogenese van pseudobulbair affect (PBA), via het vrijwillige circuit (a) of het emotionele circuit (b)
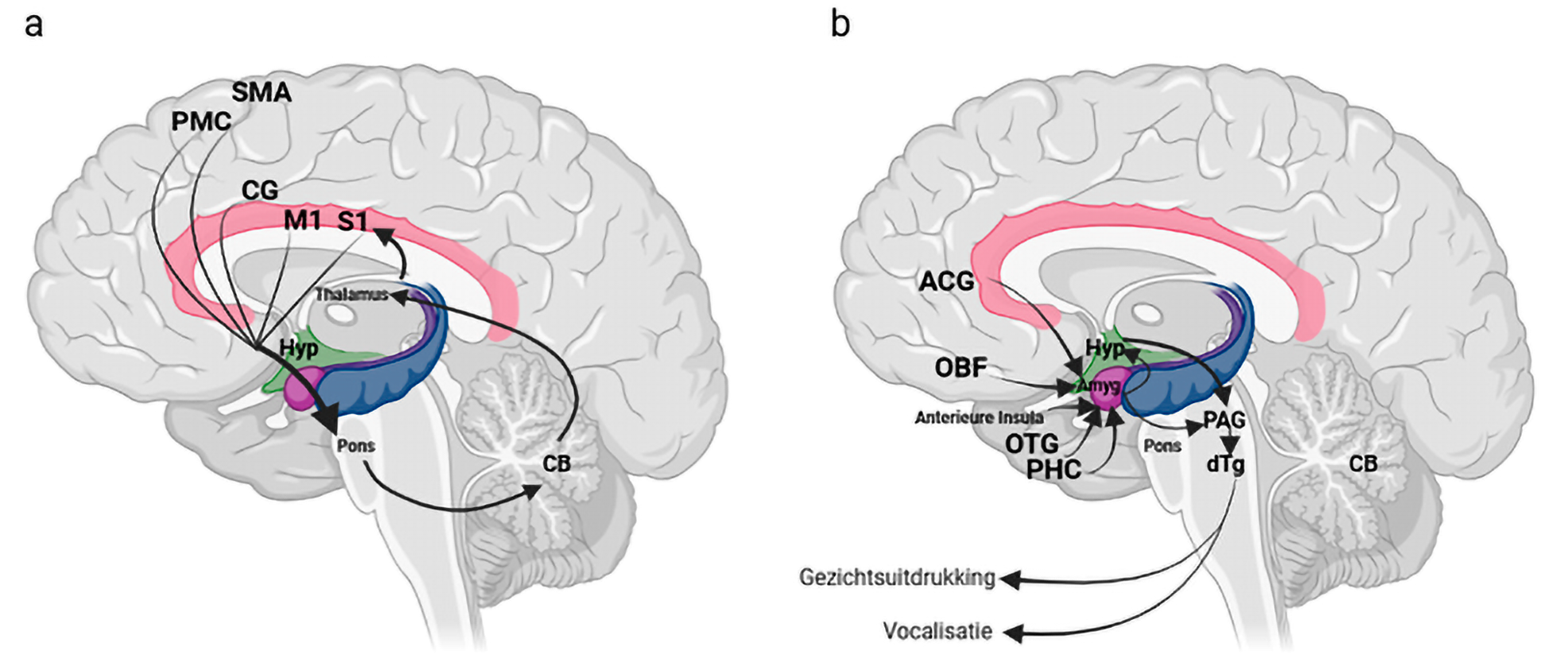
Bij het vrijwillige circuit (figuur 1a) zijn verschillende corticale regio’s betrokken. Ze projecteren via de capsula interna naar de pons en ontstaan vanuit de premotore cortex (PMC), supplementaire motore cortex (SMA), cingulaire cortex (CG), primaire motore cortex (M1) en primaire somatosensorische cortex (S1). Vervolgens bestaat er een feedbackloop, via het cerebellum en de thalamus, terug naar de cortex.
In het emotionele circuit (figuur 1b) wordt de amygdala gereguleerd door projecties vanuit de ventrale anterieure cingulaire gyrus (ACG), orbitofrontale cortex (OBF), anterieure insula, inferieure temporale gyrus (ITG), occipitotemporale gyrus (OTG) en parahippocampale cortex (PHC). De amygdala en de hypothalamus activeren op hun beurt de periaquaductale grijze stof (PAG), die via de dorsale tegmentale gebieden (dTg) de hersenstamreflexen voor lachen en huilen activeert.
Het vrijwillige circuit inhibeert en reguleert op verschillende plaatsen het emotionele circuit. De belangrijkste inhibitie vindt plaats in de peri-aquaductale grijze stof door middel van cholinerge-GABA’erge neurotransmissie. Bij neurologische aandoeningen is er vermoedelijk sprake van een two hit model met enerzijds directe laesies en anderzijds indirecte diaschisiseffecten die ontstaan door het verlies aan controle van de corticale inhibitie van een disfunctioneel emotioneel systeem.10
Vermoedelijk spelen verschillende neurotransmitters een rol: tekorten aan acetylcholine, dopamine, norepinefrine, serotonine en glutamaat kunnen de neurotransmissie in de peri-aquaductale grijze stof beïnvloeden.2
Diagnostische uitwerking van PBA
Gezien de veelheid aan mogelijke onderliggende aandoeningen is grondig klinisch psychiatrisch, neurologisch en somatisch onderzoek noodzakelijk met bijhorende technische onderzoeken. Daarnaast kan de medische en psychiatrische voorgeschiedenis richtinggevend zijn: Is er sprake van een recent hersentrauma? Is er sprake van middelenmisbruik? Een grondige exploratie van het affect, stemming en het fysieke voorkomen van de patiënt kan verduidelijking geven of er sprake is van affectieve ontregeling waarbij de lach meestal niet het gevolg is van een gevoel van vrolijkheid, al of niet in het kader van een stemmingsstoornis. Stemming wordt gezien als de duurzame, innerlijke gemoedstoestand die iemand zelf ervaart, zoals somberheid, euforie of prikkelbaarheid, waarbij affect staat voor de kortstondige, waarneembare emotionele expressie, zichtbaar in mimiek, stem en houding tijdens het onderzoek.
Volgens de psychiatrische semiologie kan er sprake zijn van affectdiscordantie, -labiliteit, -incontinentie of -vervlakking.1 Patiënten kunnen tijdens een psychotische episode pathologisch lachen, voornamelijk wanneer er sprake is van gedesorganiseerd gedrag, bizar affect of hallucinaties en wanen die interne reacties oproepen die niet gedeeld worden met de buitenwereld. Het lachen is dan incongruent met het onderwerp, affectief ontregeld en gerelateerd aan interne prikkels.
Bij een patiënt met een stemmingsstoornis kan er sprake zijn van buitensporig en ongepast lachen of huilen. Dit type is excessief en vaak ontremd in het kader van een depressieve, (hypo)mane of gemengde episode en weerspiegelt de verstoorde stemming en affectlabiliteit.
Pathologisch lachen of huilen kan ook passen bij katatonie. We spreken dan, afhankelijk van de symptomen, van stereotiep gedrag, echolalie of echopraxie. Het affect is hierbij eerder vlak en het lachen is betekenisloos en routinematig.
Om meer zicht op de ernst en de evolutie te krijgen, werd de Center for Neurologic Study-Liability Scale (CNS-LS) gebruikt.2,3 Deze veelgebruikte schaal om de ernst van PBA in te schatten en de respons op behandeling,11 is gevalideerd voor patiënten met MS en ALS. Desondanks blijft PBA in de eerste plaats een klinische diagnose. De familiale psychiatrische voorgeschiedenis met bijzondere aandacht voor stemmingsstoornissen of schizofrenie kan richtinggevend zijn in het geval van de lach als prodromaal symptoom.
Het gebruik van medicatie die een geïsoleerde pathologische lach kan uitlokken, moet worden geëvalueerd. Geïsoleerd pathologisch lachen is beschreven bij het gebruik van onder andere sumatriptan, atomoxetine en ziprasidon.12-14
Structurele en indien mogelijk functionele beeldvorming zijn doorgaans vereist om laesies in het centrale zenuwstelsel uit te sluiten.15 Laboratoriumonderzoek, waaronder lumbaalpunctie en een elektro-encefalogram (eeg), kan uitgevoerd worden op indicatie en voor verdere differentiatie.
Behandelopties
De behandeling bestaat, naast gedragstherapeutische interventies, voornamelijk uit farmacologische behandeling die met wisselend succes wordt toegepast, afhankelijk van de onderliggende pathogenese.2 In het geval van PBA blijkt de combinatie dextromethorfan/kinidine het best bestudeerd.16-19 Dextromethorfan heeft een multimodaal werkingsprofiel. Het is een NMDA-receptorantagonist en remt daardoor de glumaatgerelateerde neurotransmissie af, wat vermoedelijk de overactiviteit van het emotionele circuit remt. Daarnaast is het een zwakke heropname-inhibitor van serotonine en noradrenaline en een sigma-1-receptoragonist.16 Dextromethorfan wordt snel gemetaboliseerd (door CYP2D6) in dextrorfan en verliest daarbij zijn werking als heropname-inhibitor van serotonine en noradrenaline.2
Om het metabolisme van dextromethorfan te vertragen wordt een lage dosering kinidine (een krachtige CYP2D6-inhibitor) toegevoegd waardoor het metabolisme wordt vertraagd. De gebruikelijke dosering is 20 mg dextromethorfan/10 mg kinidine.16,18
Bij gebruik van kinidine dient men aandachtig na te gaan bij welke andere medicatie het metabolisme eveneens vertraagd wordt. Dit geldt met name voor de venlafaxine die onze patiënt gebruikte, maar ook voor andere serotonerge medicatie zoals paroxetine, fluoxetine, duloxetine en tricyclische antidepressiva (TCA’s), conform de AGNP Consensus Guidelines for Therapeutic Drug Monitoring in Psychiatry.19
Er zijn casusbeschrijvingen waarin PBA succesvol werd behandeld met lamotrigine, duloxetine, quetiapine, sertraline, mirtazapine, nortriptyline en reboxetine.3,20-25 Vermoedelijk ligt een verbeterde serotonerge of noradrenerge neurotransmissie in de peri-aquaductale grijze zone aan de basis van de vermindering van de symptomen.2
Besluit
Pathologisch lachen en huilen kan zowel bij neurologische aandoeningen als psychiatrische stoornissen voorkomen. De pathogenese hangt vermoedelijk samen met disfunctie van het vrijwillige, gedragsmatige circuit en het emotionele circuit.
Diagnostiek en behandeling vereisen multidisciplinaire samenwerking. De meest effectief gebleken behandeling van PBA in het kader van een neurologische aandoening is de combinatie van dextromethorfan 20 mg met kinidine 10 mg.16-20
De behandeling van geïsoleerd pathologisch lachen of huilen zonder aantoonbare neurologische oorzaak is minder duidelijk. Dextromethorfan/kinidine werd enkel onderzocht bij patiënten met een neurologische aandoening. De door ons beschreven casus leert dat een onderliggende psychotische stoornis overwogen dient te worden wanneer de subjectieve respons van de zorgverlener dit indiceert. Specifiek in deze casus waren tegenoverdrachtelijke gevoelens van bevreemding en angst, mogelijk deel van het prodromale stadium. Deze casus leert ons dat neurofysiologische processen ook verstoord kunnen raken zonder aantoonbare neurologische aandoening. In die zin kan PBA beschouwd worden als een functionele neurofysiologische stoornis.
Beperkingen
De literatuur over de epidemiologie en behandeling van pathologisch lachen en huilen heeft belangrijke beperkingen. Epidemiologische gegevens van PBA bij neurologische aandoeningen zijn gebaseerd op studies met relatief kleine steekproeven met uiteenlopende methodiek. Bovendien bestaat er onduidelijk over de definitie van pathologisch lachen of huilen. Over de epidemiologie bij psychiatrische stoornissen vonden we geen studies. De behandeling van PBA bij MS en ALS met dextromethorfan/kinidine is weliswaar onderzocht in verschillende RCT’s, maar de plaats van dit middel in de behandeling van PBA bij andere neurologische aandoeningen of pathologisch lachen bij psychiatrische stoornissen is niet onderzocht. Casuïstiek beperkt het wetenschappelijk bewijs van andere behandelingen voor PBA en dit punt dient in de toekomst extra aandacht te krijgen.
Literatuur
1 Beke DB, Hebbrecht M. Pathologische lach. Tijdschr Psychiatr 2007; 49: 333-7.
2 Lauterbach EC, Cummings JL, Kuppuswamy PS. Toward a more precise, clinically-informed pathophysiology of pathological laughing and crying. Neurosci Biobehav Rev 2013; 37: 1893-916.
3 Ferentinos P, Paparrigopoulos T, Rentzos M, e.a. Duloxetine for pathological laughing and crying. Int J Neuropsychopharmacol 2009; 12: 1429-30.
4 Wortzel HS, Oster TJ, Anderson CA, e.a. Pathological laughing and crying: epidemiology, pathophysiology and treatment. CNS Drugs 2008; 22: 531-45.
5 Roy D, McCann U, Han D, e.a. Pathological laughter and crying and psychiatric comorbidity after traumatic brain injury. J Neuropsychiatry Clin Neurosci 2015; 27: 299-303.
6 Wang G, Teng F, Chen Y, e.a. Clinical features and related factors of poststroke pathological laughing and crying: a case-control study. J Stroke Cerebrovasc Dis 2016; 25: 556-64.
7 Zhang L, Cao B, Wei Q, e.a. Pathological laughter and crying in multiple system atrophy with different subtypes: Frequency and related factors. J Affect Disord 2021; 283: 60-5.
8 Hanna J, Feinstein A, Morrow SA. The association of pathological laughing and crying and cognitive impairment in multiple sclerosis. J Neurol Sci 2016; 361: 200-3.
9 Hübers A, Kassubek J, Grön G, e.a. Pathological laughing and crying in amyotrophic lateral sclerosis is related to frontal cortex function. J Neurol 2016; 263: 1788-95.
10 Klingbeil J, Wawrzyniak M, Stockert A, e.a. Pathological laughter and crying: insights from lesion network-symptom-mapping. Brain 2021; 144: 3264-76.
11 Parvizi J, Arciniegas DB, Bernardini GL, e.a. Diagnosis and management of pathological laughter and crying. Mayo Clin Proc 2006; 81: 1482-6.
12 Barbanti P, Fabbrini G, Berarddelli A. Acute pathological laughter induced by sumatriptan. Cephalalgia 2008; 28: 92-3.
13 Park JM, Kim YW, Choi S. Atomoxetine (Strattera)-induced pathologic laughing in a patiënt with pontine hemorrhage: a case report. Clin Neuropharmacol 2021; 44: 77-9.
14 Schindehühe J, Trenkwalder C. Treatment of drug-induced psychosis in Parkinson’s disease with ziprasidone can induce severe dose dependent off-periods and pathological laughing 2007; 109: 188-91
15 Morland D, Wolff V, Blondet C, e.a. Pathological laughing: Brain SPECT findings. Clin Nucl Med 2015; 40: 734-6.
16 Brooks BR, Thisted RA, Appel SH, e.a.; AVP-923 ALS Study Group. Treatment of pseudobulbar affect in ALS with dextromethorphan/quinidine: a randomized trial. Neurology 2004; 63: 1364-70.
17 Hammond FM, Alexander DN, Cutler AJ, e.a. PRISM II: an open-label study to assess effectiveness of dextromethorphan/quinidine for pseudobulbar affect in patients with dementia, stroke or traumatic brain injury. BMC Neurol 2016; 16: 89.
18 Panitch HS, Thisted RA, Smith RA, e.a.; Pseudobulbar Affect in Multiple Sclerosis Study Group. Randomized, controlled trial of dextromethorphan/quinidine for pseudobulbar affect in multiple sclerosis. Ann Neurol 2006; 59: 780-7.
19 Hiemke C, Bergemann N, Clement HW, e.a. AGNP Consensus Guidelines for Therapeutic Drug Monitoring in Psychiatry: Update 2017. Pharmacopsychiatry 2018; 51: 9-62.
20 Chahine LM, Chemali Z. Du rire aux larmes: pathological laughing and crying in patients with traumatic brain injury and treatment with lamotrigine. Epilepsy Behav 2006; 8: 610-5.
21 Shin SH, Kim YW, Kim NY. Treatment of poststroke pathologic lauging with duloxetine: a case series. Clin Neuropharmacol 2019; 42: 60-3.
22 Chen YR, Huang YP, Lin SJ, e.a. Effectiveness of quetiapine for poststroke pathological laughing: case report and review of the literature. Clin Neuropharmacol 2010; 33: 319-22.
23 Takeuchi H, Iwamoto K, Mukai M, e.a. Effective use of sertraline for pathological laughing after severe vasospasm due to aneurysmal subarachnoid hemorrhage: case report. Neurol Med Chir 2014; 54: 231-5.
24 Kim SW, Shin IS, Kim JM e.a. Mirtazapine treatment for pathological laughing and crying after stroke. Clin Neuropharmacol 2005; 28: 249-51.
25 Møller M, Andersen G. Inhibition of selective noradrenergic reuptake as treatment of pathological laughter. J Clin Psychopharmacol 2007; 27: 108-10.
Auteurs
Pieter Vanbrabant, arts in opleiding tot psychiater, Jessa, Hasselt.
Lisa van Hilst, zesdejaars studente geneeskunde, UGent.
Sven Estercam, psychiater, medisch diensthoofd afd. Psychiatrie, Jessa, Hasselt en St. Franciscusziekenhuis, Heusden-Zolder.
Correspondentie
Sven Estercam (sven.estercam@jessazh.be).
Geen strijdige belangen gemeld.
Het artikel werd voor publicatie geaccepteerd op 13-11-2025.
Citeren
Tijdschr Psychiatr. 2026;68(2):86-90
