Cognitive functioning in psychotic spectrum disorders: current status and clinical implications
Background Although cognitive impairments occur in approximately 70% of individuals with a psychotic spectrum disorder (PSS) and have a substantial impact on daily functioning, they are often underrecognized in clinical practice. Due to their limited specificity, they are not included in the DSM classification criteria. Historically, cognitive deficits were already central to the concept of dementia praecox.
Aim To provide an overview of the literature on cognition in psychosis.
Method This article summarizes the existing literature on cognition in PSS.
Results Patients with PSS generally score lower than the general population across nearly all cognitive domains, although no specific cognitive deficit is unique to PSS, and variability between patients is considerable. The article further discusses the prevalence and course of cognitive dysfunction, as well as findings from neuroimaging and genetic studies. After a first psychotic episode, it is recommended to screen cognitive functioning, for instance using the MATRICS battery. Pharmacological treatment typically shows only modest positive effects on cognitive impairment. In contrast, cognitive remediation (CR) – aimed at improving or compensating cognitive functions through strategies and training – has shown beneficial effects. Although clinical guidelines recommend CR, its availability in practice remains limited.
Conclusion Integrating systematic cognitive screening and CR into treatment may contribute to improved functioning and quality of life...
Cognitieve functiestoornissen komen veelvuldig voor bij PSS. We zien dit terug in de typering van de voorganger van de term schizofrenie: dementia praecox.
Kraepelin (1919) omschreef dementia praecox als een vroegtijdige vorm van dementie en beschouwde cognitieve functiestoornissen als een centraal onderdeel van deze aandoening.1 De behandeling richtte zich destijds vooral op de meer in het oog springende psychotische symptomen, en ruim honderd jaar later is dat niet wezenlijk veranderd.
Cognitieve functiestoornissen worden niet expliciet genoemd als criterium voor PSS in de DSM-5-TR, noch in eerdere edities. Tijdens de ontwikkeling van de DSM-5 is overwogen om cognitieve functiestoornissen als symptoom op te nemen in de diagnostische criteria. Uiteindelijk werd echter geconcludeerd dat deze symptomen te aspecifiek zijn en daardoor onvoldoende bijdragen aan classificatie.
Hoewel onderzoek inderdaad laat zien dat cognitieve functiestoornissen veel voorkomen bij diverse classificaties, zijn deze zeer prominent aanwezig en vaak ernstig bij mensen met PSS.2 Inmiddels worden PSS beschouwd als een verzameling van symptoomdimensies. Volgens diverse publicaties vormen cognitieve functiestoornissen een van deze symptoomdimensies; overige dimensies zijn wanen, hallucinaties, gedesorganiseerde spraak, abnormale psychomotoriek, negatieve, manische en depressieve symptomen.3,4
Ontwikkeling van cognitieve functiestoornissen
PSS ontstaan vaak in de leeftijd van 18-25 jaar, maar cognitieve functiestoornissen zijn vaak al veel eerder aanwezig.5 De cognitieve functies gaan verder achteruit voorafgaand aan het ontstaan van de eerste psychotische episode. Deze verstoringen kunnen later in het leven, vaak tijdens de adolescentie of vroege volwassenheid, ernstiger worden, wanneer het brein verder rijpt en onder druk komt te staan door bijvoorbeeld stress of hormonale veranderingen.
Relevante cognitieve domeinen
Cognitieve functiestoornissen bij PSS zijn heterogeen van aard: clusteranalyses van ruwe testscores laten zien dat de variatie in cognitieve prestaties bij mensen met PSS net zo groot is als in de algemene populatie, er zijn mensen met psychotische stoornissen met heel ernstige functiestoornissen en mensen bij wie het cognitief functioneren nauwelijks is beperkt.6
Er is geen eenduidig cognitief profiel dat met neuropsychologisch onderzoek kan worden vastgesteld. Daarom wordt een bredere screening van cognitieve functies aanbevolen om beter te begrijpen welke problemen mensen in het dagelijks leven ervaren. Twee decennia geleden presenteerde een collectief uit de Verenigde Staten op basis van de destijds beschikbare literatuur zes cognitieve domeinen die relevant zijn om op te nemen in neuropsychologisch onderzoek bij PSS:7
– snelheid van informatieverwerking;
– aandacht/vigilantie;
– werkgeheugen;
– verbaal leren en geheugen;
– visueel leren en geheugen;
– redeneren en probleem oplossen.
Aan deze domeinen is later sociale cognitie toegevoegd, vanwege de voorspellende waarde voor het functioneren in het dagelijkse leven.
Neuro- en sociaal-cognitieve functiestoornissen gaan vaak samen met beperkingen in activiteiten en participatie.8 Zo vergroten goede executieve functies bijvoorbeeld de kans dat iemand de overstap kan maken van beschermd naar zelfstandig wonen.9
Stadiëring
Volgens het stadiëringsmodel kunnen we PSS onderverdelen in meerdere stadia, die oplopen in ernst en ziekteduur (zie figuur 1).10
Dit stadiëringsmodel sluit aan bij het concept van een psychosecontinuüm, waarbij psychosegerelateerde ervaringen in wisselende mate voorkomen: van licht en laagfrequent in de algemene populatie tot ernstig bij mensen met een chronisch beloop van een psychotische stoornis. Ook het cognitief functioneren varieert per fase van de stoornis.
Figuur 1. Stadia van psychosespectrumstoornissen (overgenomen uit de zorgstandaard Psychose)
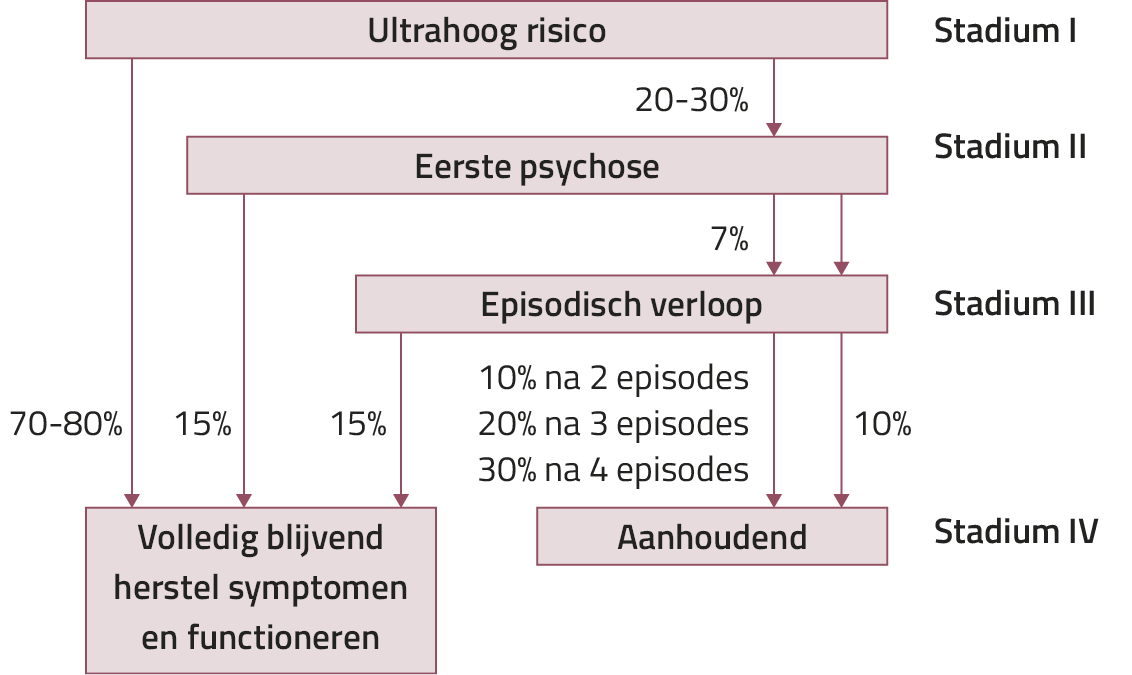
We beschrijven eerst per stadium de veranderingen in cognitief functioneren.
Premorbide stadium. Dit stadium staat niet in de figuur en is preklinisch. Al op jonge leeftijd zijn er gemiddeld slechtere prestaties op diverse cognitieve domeinen.11,12
UHR-stadium (ultrahoog risico). Cognitief functioneren is over de hele linie significant slechter dan bij de algemene bevolking, behalve op snelheid van informatieverwerking.13 Ook sociale cognitie is aangetast.14 Neuropsychologische tests tonen scores tussen die van personen zonder en mensen met PSS.15 Transitie naar psychose lijkt specifiek samen te gaan met een slechter verbaal geheugen en slechtere volgehouden aandacht.16
Eerste psychotische episode. Deze gaat vaak gepaard met een daling in sociaal functioneren en cognitieve prestaties tot één standaarddeviatie onder het gemiddelde.17 Na deze fase blijven cognitieve functies gemiddeld stabiel.18
Chronische fase. Cognitief functioneren blijft vergelijkbaar met dat tijdens de eerste episode. Resultaten over het verdere beloop zijn gemengd: sommige studies tonen verbetering, andere achteruitgang.20,21 Door verminderde cognitieve reserves is het risico op neurodegeneratieve aandoeningen verhoogd.17
Etiologische factoren
Genetica
Er zijn meerdere factoren die de ontwikkeling van cognitieve functies bij PSS beïnvloeden. Genetische invloeden spelen hierbij een belangrijke rol. Maar het is niet zo dat het risico op PSS kan worden toegeschreven aan één of enkele specifieke genen. Onderzoek toont aan dat een groot aantal genen betrokken is bij PSS (> 300), wat wijst op een complexe genetische basis. Met andere woorden: er is geen mendeliaanse oorsprong van PSS. Evenzo zijn cognitieve functiestoornissen gekoppeld aan diverse genetische varianten. Individuele allelen vertonen slechts zwakke verbanden met cognitief functioneren, waardoor het ook hier gaat om een complexe genetische associatie.22
Zowel tweelingstudies als grootschalige genoombrede associatiestudies (GWAS) tonen aan dat er een aanzienlijke overlap bestaat tussen de genetische kwetsbaarheid voor PSS en cognitieve functiestoornissen.23,24 Wat dat precies betekent, is echter niet duidelijk. Het kan zijn dat risico op PSS een verhoogd risico op cognitieve functiestoornissen meebrengt, of andersom. Ook kan aan beide eenzelfde mechanisme ten grondslag liggen.
Omgevingsfactoren
Naast genetische factoren gaan ook perinatale complicaties, traumatisch gebeurtenissen in de kindertijd en lagere sociaaleconomische status vroeg in het leven samen met slechter cognitief functioneren later in het leven.23,25 Ook leefstijlgerelateerde factoren, zoals fysieke activiteit en gebruik van middelen, hangen samen met het cognitief functioneren. Met name roken, gebruik van cannabis, overgewicht en diabetes mellitus zijn in verband gebracht met de achteruitgang van cognitieve functies bij mensen met PSS, evenals bij diverse andere psychische aandoeningen.23
Intracerebrale afwijkingen
Zowel functionele als structurele verschillen worden gevonden tussen mensen met een kwetsbaarheid voor psychosen en de algemene populatie. Structurele beeldvormingsstudies laten zien dat er een vermindering is van grijze stof, met name in de frontale en mediale gebieden en in de subcorticale gebieden zoals de amygdala en de hippocampus en een verminderde dikte van de cortex.27,28 Structurele afwijkingen zijn gerelateerd aan verminderd cognitief functioneren in alle domeinen van Measurement and Treatment Research to Improve Cognition in Schizophrenia (MATRICS).29 Ook functionele neuro-imagingstudies laten een consistente relatie zien tussen activiteit in hersengebieden en het cognitief functioneren.30
Zo wordt de linker dorsolaterale prefrontale cortex (DLPFC) vaak geassocieerd met bewust gecontroleerde hogere-orde cognitieve processen, zoals mentale flexibiliteit en werkgeheugen. De ventromediale prefrontale cortex speelt daarentegen een belangrijke rol in hogere-orde sociale en emotionele processen. Ook de amygdala en verschillende temporale en pariëtale gebieden zijn geassocieerd met sociale cognitie.26
Hoewel ook tegenwoordig nog altijd wordt gekeken naar de relatie tussen de activatie van hersengebieden en specifieke cognitieve taken, rapporteerde men in latere studies dat cognitief functioneren niet zozeer samenhangt met activatie in één specifiek hersengebied, maar eerder met de gelijktijdige activatie van meerdere hersengebieden en de connectiviteit daartussen, oftewel neurale netwerken.26 Zo laat een systematische review zien dat afwijkende connectiviteit tussen corticale en subcorticale gebieden, zoals de cortico-cerebellaire-striatale-thalamische lus, samenhangt met tekorten in het executief functioneren, werkgeheugen en verwerkingssnelheid.31 Daarnaast is abnormale connectiviteit tussen delen van het netwerk dat vooral actief is in rust (het default-modenetwerk) en onder andere de DLPFC geassocieerd met meerdere cognitieve domeinen. Onderzoek waarbij men gebruikmaakt van dergelijke technieken laat zien dat er geen enkel netwerk is dat specifiek met één enkele cognitieve functie geassocieerd kan worden. Dit suggereert dat verstoringen in netwerken samengaan met algemene, generieke cognitieve functiestoornissen.26,29
Neurotransmitters
Er zijn verschillende neurotransmittersystemen betrokken bij de symptomen van mensen met een PSS, met name dopaminerge, GABA-erge (gamma-aminoboterzuur), cholinerge en glutamerge systemen.23 Een aantal van deze neurotransmittersystemen wordt in verband gebracht met cognitieve functiestoornissen. Dopaminerge neurotransmissie wordt in verband gebracht met veranderingen in het belang dat wordt gehecht aan waarnemingen en gedachten (verstoorde salience) die kenmerkend zijn voor psychotische stoornissen.32 Dopamine ondersteunt de hersenactiviteit die nodig is bij het richten van aandacht en onderdrukken van irrelevante signalen en is betrokken bij processen zoals aandacht, werkgeheugen en executief functioneren. Verstoring van dopamineafgifte kan daarom leiden tot problemen met deze processen.33,34
Ook het muscarinesysteem, onderdeel van de cholinerge neurotransmissie, speelt een rol.35 Verstoring hiervan kan zowel cognitieve klachten als psychotische symptomen versterken. Stoffen die de werking van muscarinereceptoren blokkeren, verergeren cognitieve beperkingen en kunnen zelfs psychotische klachten opwekken bij mensen zonder psychotische stoornis. Bij mensen met psychose zijn in de hippocampus en cortex minder M1- en M4-muscarinereceptoren aanwezig, wat in verband staat met cognitieve klachten. M1-receptoren zijn belangrijk voor leren en geheugen; activatie van deze receptoren kan cognitieve functies en mogelijk ook psychotische symptomen verbeteren.35
Er zijn ook aanwijzingen dat de N-methyl-D-aspartaat(NMDA)-receptoren bij mensen met PSS minder goed functioneren.36 Deze aanwijzingen worden ondersteund door de bevinding dat stoffen die de functie van de NMDA-receptor verminderen, zoals ketamine, zowel negatieve symptomen als psychotische verschijnselen kunnen veroorzaken bij mensen zonder PSS. Een verminderde werking van de NMDA-receptoren beïnvloedt ook het functioneren van GABA, een andere neurotransmitter. Dit kan de balans tussen excitatie en inhibitie in de hersenen verstoren, wat kan bijdragen aan symptomen zoals prikkelbaarheid, angst en cognitieve stoornissen.36
Ten slotte heeft ook de neurotransmitter acetylcholine een direct verband met cognitief functioneren, en met name met aandacht en geheugen. Acetylcholine is o.a. gelinkt aan het nicotinesysteem. Bij mensen met een PSS zijn de acetylcholineniveaus vaak lager.
Dit zou een verklaring kunnen zijn voor de hoge prevalentie van tabaksverslaving bij deze doelgroep; roken kan bij deze doelgroep namelijk leiden tot een tijdelijke verbetering van de cognitieve functies.23 Op langere termijn is roken geassocieerd met slechter cognitief functioneren, zowel in de algemene bevolking als bij mensen met een PSS. Dit wordt waarschijnlijk veroorzaakt door neuronale en vasculaire schade door de schadelijke stoffen die worden geïnhaleerd tijdens roken. Er zijn aanwijzingen dat de snelheid van informatieverwerking toeneemt als mensen met PSS stoppen met roken.37 Ook zijn er recent aanwijzingen gevonden dat roken een belangrijke ongunstige factor is in de ontwikkeling van psychotische stoornissen en dat dit verband loopt via een verminderde snelheid van informatieverwerking.38
Neuropsychologisch onderzoek van cognitieve functiestoornissen volgens de zorgstandaard
Het in kaart brengen van cognitieve functies helpt bij het begrijpen van problemen in het dagelijks functioneren. Gezien de impact van cognitieve functiestoornissen op activiteiten en participatie wordt in de zorgstandaard dan ook aanbevolen bij een eerste psychose alle symptoomdimensies, waaronder cognitieve functiestoornissen, standaard in kaart te brengen.
Voor het screenen van cognitieve functiestoornissen kan gebruik worden gemaakt van een gestandaardiseerde testbatterij. Hierbij kunnen de cognitieve domeinen in de cognitieve testbatterij volgens de MATRICS-consensus als uitgangspunt dienen.39 In tabel 1 staat de gehele MATRICS-batterij weergegeven.
Tabel 1. Cognitieve testbatterij volgens de MATRICS-consensus
|
Cognitief domein |
Test(s) |
Doel |
|---|---|---|
|
Speed of Processing (snelheid van informatieverwerking) |
Trail Making Test – Part A (TMT-A); BACS Symbol Coding; categorie Fluency (Animal Naming) |
Meet snelheid van visueel-motorische verwerking, symbolen coderen en verbale vloeiendheid |
|
Attention/vigilance (aandacht/vigilantie) |
Continuous Performance Test – Identical Pairs (CPT-IP) |
Meet volgehouden aandacht en responsbetrouwbaarheid |
|
Working memory (werkgeheugen) |
WMS-III Spatial Span; Letter-Number Span |
Meet kortetermijngeheugen en manipulatie van informatie |
|
Verbal learning (verbaal leren) |
Hopkins Verbal Learning Test – Revised (HVLT-R) |
Meet leren en herinneren van verbale informatie |
|
Visual learning (visueel leren) |
Brief Visuospatial Memory Test – Revised (BVMT-R) |
Meet leren en herinneren van visueel-ruimtelijke informatie |
|
Reasoning/problem-solving (redeneren en probleemoplossing) |
Neuropsychological Assessment Battery – Mazes (NAB Mazes) |
Meet planning en probleemoplossend vermogen |
|
Social cognition (sociale cognitie) |
Mayer-Salovey-Caruso Emotional Intelligence Test – Managing Emotions (MSCEIT ME) |
Meet vermogen om emoties te begrijpen en te reguleren in sociale context |
BACS: Brief Assessment of Cognition in Schizophrenia; WMS: Wechsler Memory Scale.
Omdat veel instellingen de volledige MATRICS-batterij niet hebben, is een alternatief om per cognitief domein te kiezen voor beschikbare, betrouwbare en gevalideerde vergelijkbare tests.
In latere fasen gebeurt neuropsychologisch onderzoek op indicatie, bijvoorbeeld bij veranderingen in medicatie, de wens tot werkhervatting of signalen van cognitieve achteruitgang. De multidisciplinaire richtlijn Schizofrenie adviseert om cognitieve functies in kaart te brengen wanneer de psychotische symptomen in remissie zijn.40 Soms blijven symptomen echter aanhouden, wat het neuropsychologisch onderzoek kan beïnvloeden, bijvoorbeeld doordat mensen continu worden afgeleid door hallucinaties. In zulke gevallen biedt neuropsychologisch onderzoek een weergave van de status quo, waarbij beschreven wordt hoe iemands cognitief functioneren gegeven de aanwezige symptomen is. Wanneer deze symptomen chronisch aanwezig zijn, geeft het onderzoek desondanks een realistisch beeld van iemands mogelijkheden.
Als alternatief voor neuropsychologisch testen kan gebruik worden gemaakt van een interview, zoals het Cognitive Assessment Interview.41 Hoewel dergelijke interviews minder geschikt zijn voor het objectief meten van cognitieve functies, bieden ze wel waardevol inzicht in de subjectieve cognitieve problemen die iemand in het dagelijks leven ervaart. Deze interviews zijn inzetbaar gedurende alle fasen van de stoornis en vormen daarmee een bruikbaar alternatief wanneer traditionele cognitieve tests niet haalbaar zijn.
Behandeling
De behandeling van de cognitieve functiestoornissen bij psychose is niet voorbehouden aan een specifieke discipline en is een multidisciplinaire aangelegenheid. We beschrijven de medicamenteuze en gedragsmatige behandelopties.
Medicamenteuze behandeling van cognitieve functiestoornissen
Antipsychotica vormen een integraal onderdeel van de behandeling van PSS. Onderzoek toont aan dat cognitieve functiestoornissen vaak al aanwezig zijn vóór de start van antipsychotische medicatie en ook voorkomen bij patiënten die geen antipsychotica gebruiken.42 Dit suggereert dat cognitieve functiestoornissen niet uitsluitend een gevolg zijn van het gebruik van deze medicatie.
Veel onderzoeken naar de effecten van antipsychotica op cognitie zijn naturalistische cohortstudies, waarin het moeilijk is om het effect van medicatie te onderscheiden van het natuurlijke beloop van de aandoening. Ongeveer 50% van de mannen en tot 70% van de vrouwen melden concentratieproblemen of vermoeidheid bij het gebruik van antipsychotische medicatie, wat forse invloed kan hebben op het dagelijks functioneren.43
De eerste RCT naar de relatie tussen medicatie en cognitie was van Nederlandse origine.44 In deze studie werd bij patiënten met een eerste psychose in remissie de medicatie óf gecontinueerd óf geleidelijk afgebouwd. De groep bij wie de medicatie werd afgebouwd, liet na afbouw meer vooruitgang zien op taken die een beroep deden op mentale snelheid en flexibiliteit.45 Momenteel wordt deze studie gerepliceerd in verschillende landen; bij het schrijven van dit artikel zijn de resultaten van deze replicatie nog niet gepubliceerd.46,47
Een meta-analyse van RCT’s uitgevoerd in 2020 toonde aan dat dosisvermindering het risico op terugval verhoogde, maar de neurocognitieve functies verbeterde.48 De langetermijneffecten van medicatie op cognitieve functies zijn nog steeds onduidelijk. Er is meer kennis nodig over hoe onderhoudstherapie en dosisreductie het cognitief functioneren beïnvloeden bij PSS. Op basis van de huidige inzichten is het behandeladvies om voor- en nadelen van dosisreductie met de patiënt op een rij te zetten en vanuit gezamenlijke besluitvorming tot behandelbeleid te komen.
In een recente tripelblinde gerandomiseerde studie werden mensen met een psychotische stoornis die nooit eerder antipsychotica gebruikten zes maanden lang met risperidon, paliperidon of een placebo behandeld.49 Daarnaast werd een controlegroep mensen uit de algemene populatie zes maanden gevolgd. Bij de start van het onderzoek waren er geen verschillen tussen de patiëntgroepen op de cognitieve maten, terwijl de prestatie van de controlegroep significant beter was. Over de periode van zes maanden gingen alle groepen vooruit op maten voor verwerkingssnelheid, aandacht en cognitieve controle en bleven zij stabiel op verbale vloeiendheid en werkgeheugen. De placebo- en de controlegroep gingen vooruit op diverse geheugentaken (onmiddellijke herinnering, uitgestelde herinnering en verbaal leren), terwijl de medicatieconditie achteruitging op deze maten.
Hoewel antipsychotica niet specifiek zijn ontwikkeld om de cognitie te verbeteren, kunnen sommige middelen een positief effect hebben op cognitieve functies. Een recente netwerkmeta-analyse toont echter aan dat het effect van antipsychotische medicatie op cognitie nauwelijks verschilt van dat van een placebo.50 Bovendien werden er vrijwel geen significante verschillen tussen de onderzochte antipsychotica gevonden. De cognitieve functies verbeterden het minst bij behandeling met haloperidol, flufenazine (niet meer geregistreerd in Nederland en Europa) en clozapine.
Wanneer een patiënt hinder ondervindt van cognitieve functiestoornissen en last heeft van sufheid of psychomotorische traagheid, dan is het te overwegen om over te stappen op een antipsychoticum met minder sederende bijwerkingen zoals aripiprazol of amisulpride.51 Er zijn ten slotte aanwijzingen dat anticholinergica en antipsychotica met sterke anticholinerge eigenschappen cognitieve functies verslechteren.52
Gedragsmatige behandeling van cognitieve functiestoornissen
Gedragsmatige behandelvormen die specifiek ontwikkeld zijn voor mensen met cognitieve functiestoornissen richten zich op het verbeteren van het functioneren middels het verbeteren van cognitieve vaardigheden, oftewel cognitieve remediatietrainingen (CRT) of op het compenseren van cognitieve problemen met individuele en/of omgevingshulpmiddelen, oftewel cognitieve compensatietrainingen.53,54 Het gaat bij CRT soms om het herhaaldelijk doen van bepaalde taken (bijv. het onthouden van verbaal materiaal), maar meestal om het aanleren van nieuwe strategieën om cognitieve functiestoornissen te omzeilen.
Cognitieve remediatietrainingen. Een gangbare definitie van CRT is ‘een gedragsmatige training, gericht op cognitieve functiestoornissen met als doel het verbeteren van het functioneren in het dagelijkse leven. De effectiviteit wordt versterkt wanneer de training wordt aangeboden in een context die steun en mogelijkheden geeft voor de generalisatie naar het dagelijks functioneren’ (Cognitive Remediation Expert Working Group, geciteerd door Barlati e.a.).55
CR-interventies bestaan vaak uit oefeningen die gericht zijn op het verbeteren van cognitieve functies en het vergroten van inzicht in de eigen cognitieve vaardigheden (metacognitie). Vaak werken deelnemers aan zelf geformuleerde doelen, over het algemeen gericht op het verbeteren van hun functioneren in het dagelijkse leven.
Zowel bij mensen met een eerste psychose als bij mensen met een langdurige PSS is CR effectief gebleken in het verbeteren van het dagelijks en beroepsmatig functioneren.56,57 De effecten lijken echter kleiner bij mensen met een eerste psychose dan bij degenen die al langer kampen met een PSS.54
Onderzoek laat zien dat CR leidt tot betere prestaties op neuropsychologische tests, maar dat deze effecten zich niet automatisch ook vertalen naar beter functioneren in het dagelijks leven. Wanneer CR gecombineerd wordt met interventies die zich richten op activiteiten (zoals het trainen van sociale vaardigheden) en participatie (zoals arbeidsrehabilitatie), wordt wel vaker een positief effect op het dagelijks functioneren gevonden.54
Op basis van de literatuur over de effecten van CR heeft de internationale werkgroep voor CR vier essentiële elementen benoemd die nodig zijn om overdracht van de geleerde vaardigheden naar het dagelijks leven te bevorderen.53
– cognitieve oefeningen;
– cognitieve strategieën;
– generalisatieoefeningen en -strategieën;
– begeleiding door een ervaren therapeut.
Recent onderzoek bevestigt dat interventies die alle vier de essentiële elementen van CR bevatten de grootste effectiviteit laten zien op het verbeteren van het functioneren in het dagelijks leven.58
Cognitieve compensatietrainingen. In plaats van het trainen van cognitieve functies wordt er soms gekozen voor compensatie voor de effecten van cognitieve functiestoornissen, bijvoorbeeld door aanpassingen in de omgeving van de patiënt. Dit kan bestaan uit het zoeken van passend ander werk of het inzetten van ondersteunende apps om dagelijkse afspraken en taken te organiseren. Een recente meta-analyse laat zien dat dit soort compensatietrainingen effectief zijn voor het verbeteren van het functioneren van deelnemers en bovendien een duurzaam effect hebben.54
Een voorbeeld van een evidencebased cognitieve compensatietraining die ook in Nederland wordt toegepast, is cognitieve adaptatietraining (CAT). Deze is gericht op het compenseren van met name executieve functiestoornissen door praktische hulpmiddelen in te zetten om iemands omgeving te structureren, zoals een digitale agenda op de mobiele telefoon of het organiseren van de kledingkast met labels.59 CAT heeft bij mensen met ernstige psychiatrische aandoeningen zelfs geleid tot verbeteringen in cognitief functioneren.57
Sociale cognitie wordt in de CR-literatuur vaak als een afzonderlijk cognitief domein besproken. Omdat sociale cognitie dichter bij de sociaal functioneren in het dagelijks leven in de buurt komt, werd verwacht dat training van sociale cognitie een groter effect zou hebben op het functioneren in het dagelijks leven. Hoewel er inderdaad positieve effecten zijn gevonden op de getrainde aspecten van sociale cognitie, zijn deze vergelijkbaar met andere vormen van CR en blijkt ook hier dat de generalisatie naar andere domeinen en het dagelijks functioneren vaak beperkt is.60
In de zorgstandaard Psychotische stoornissen wordt CR genoemd als optionele behandeling. In de Europese richtlijnen wordt CR aanbevolen voor de behandeling van cognitieve stoornissen bij mensen met schizofrenie.61 Aanbevolen wordt CR aan te bieden als geïntegreerde behandeling, om generalisatie van effecten te bevorderen.
Naast CR zijn ook interventies gericht op lichaamsbeweging effectief gebleken bij het verbeteren van cognitieve functies bij PSS.61,62
Implicaties voor de klinische praktijk
Cognitieve functiestoornissen komen veelvuldig voor bij PSS en hebben een negatieve invloed op het functioneren in het dagelijks leven. Deze stoornissen worden daarnaast beschouwd als belemmerende factoren voor het optimaal benutten van behandelingen. Voorbeelden hiervan zijn het vergeten van behandelafspraken of het moeite hebben met het vasthouden van inzichten uit de behandeling. De betrokkenheid van zorgverleners met specifieke kennis van cognitieve functiestoornissen bij de behandeling lijkt daarbij cruciaal.
Neuropsychologische diagnostiek en gerichte behandeling in de klinische praktijk zijn maatwerk. Vaak springen andere symptomen echter meer in het oog en krijgen daardoor prioriteit in de behandeling. Ook zijn zorgverleners vaak onvoldoende op de hoogte van beschikbare behandelingsmogelijkheden op dit gebied of beschikken niet over voldoende kennis van cognitieve stoornissen. Bovendien is er in toenemende mate een tekort aan professionals die interventies kunnen aanbieden. Ten slotte zijn patiënten en hun naasten zich vaak niet bewust van de aanwezige cognitieve functiestoornissen en het effect daarvan op hun dagelijks leven, waardoor dit onderwerp niet ter sprake komt.
Het is daarom van groot belang dat binnen een multidisciplinair team iemand met voldoende kennis van neuropsychologie aanwezig is, zoals een klinisch neuropsycholoog of een gespecialiseerde GZ-psycholoog. Met de juiste kennis en ervaring wordt het gemakkelijker om cognitieve problemen te signaleren en te relateren aan de problemen die iemand ervaart in het dagelijks leven.
Verpleegkundigen, die patiënten vaak in hun eigen omgeving zien, spelen een belangrijke rol in het herkennen en signaleren van cognitieve problemen en kunnen bijdragen aan het trainen van cognitieve vaardigheden. Zij missen echter vaak de kennis die nodig is om cognitieve problemen in het dagelijkse leven te herkennen. Het is daarom essentieel dat in de opleiding van verpleegkundigen meer aandacht wordt besteed aan cognitieve stoornissen en de impact daarvan.
Er is vaak een discrepantie tussen objectieve en subjectieve cognitieve functiestoornissen.63 Dit kan voortkomen uit verminderde reflectieve vermogens bij de cliënt, waardoor deze de functiestoornissen zelf niet herkent, en deze daardoor ook minder goed door zorgverleners worden opgemerkt. Vanwege deze discrepantie maakt men bij de terugkoppeling van neuropsychologisch onderzoek zo veel mogelijk een koppeling met relevante voorbeelden uit het dagelijks leven, en geeft adviezen hoe de cliënt rekening kan houden met eventuele cognitieve problemen. Als dit niet gebeurt, blijft het neuropsychologisch onderzoek vaak slechts een rapport in het dossier zonder bij te dragen aan de behandeling. Het is daarom van belang om de inzichten uit neuropsychologisch onderzoek actief te integreren in de multidisciplinaire behandeling voor mensen met een PSS.
Vaak wordt in de nabespreking gevraagd of de cognitieve functies zich in de toekomst zullen herstellen. Op basis van de huidige literatuur kunnen we geen eenduidig antwoord geven op de vraag hoe cognitieve functiestoornissen zich over de tijd ontwikkelen. Gemiddeld lijkt er vóór de eerste psychose sprake te zijn van een achteruitgang in het cognitieve functioneren, waarna na de eerste episode stabilisatie optreedt. Echter, het beloop kan op individueel niveau sterk fluctueren.
Obstakels voor implementatie van cognitieve remediatie
CR wordt, ondanks positieve resultaten, te weinig aangeboden. Hier zijn factoren zoals beperkte menskracht en beperkte toegang tot behandelmethoden debet aan. Lang niet alle interventies vinden hun weg naar de klinische praktijk. Effectief bewezen interventies (zoals de CIRCuiTS-training (Computerised Interactive Remediation of Cognition – a Training for Schizophrenia), gericht op het verbeteren van executieve functiestoornissen, die in het VK ontwikkeld is en goed is onderzocht)64 zijn vaak niet kosteloos en niet eenvoudig beschikbaar. Licenties kan men alleen tegen betaling bij de onderzoekers verkrijgen en men dient te betalen voor training in de methodiek. Onderzoekers zouden bij kunnen dragen aan de implementatie van CR in de klinische praktijk door deze effectieve interventies kosteloos beschikbaar te stellen.
Conclusie
Wij zijn ervan overtuigd dat de betere implementatie van neuropsychologische diagnostiek en behandeling in de klinische praktijk kan bijdragen aan een beter begrip van de problemen die mensen met een psychotische stoornis ervaren, zowel door henzelf, hun behandelaars als hun naasten.
Bovendien kan CR, wanneer deze wordt gecombineerd met interventies op het gebied van activiteiten en participatie, bijdragen aan zowel maatschappelijk als persoonlijk herstel.
Literatuur
1 Kraepelin E. Die Erforschung psychischer Krankheitsformen. Z Gesamte Neurol Psychiatr 1919; 51: 224-46.
2 Abramovitch A, Short T, Schweiger A. The C Factor: Cognitive dysfunction as a transdiagnostic dimension in psychopathology. Clin Psychol Rev 2021; 86: 102007.
3 Van Os J, Kapur S. Schizophrenia. Lancet 2009; 374: 635-45.
4 Heckers S, Barch DM, Bustillo J, e.a. Structure of the psychotic disorders classification in DSM 5. Schizophr Res 2013; 150: 11-4.
5 Cornblatt B, Obuchowski M, Roberts S, e.a. Cognitive and behavioral precursors of schizophrenia. Dev Psychopathol 1999; 11: 487-508.
6 Joyce EM, Roiser JP. Cognitive heterogeneity in schizophrenia. Curr Opin Psychiatry 2007; 20: 268-72.
7 Green MF, Nuechterlein KH, Gold JM, e.a. Approaching a consensus cognitive battery for clinical trials in schizophrenia. Biol Psychiatry 2004; 56: 301-7.
8 Halverson TF, Orleans Pobee M, Merritt C, e.a. Pathways to functional outcomes in schizophrenia spectrum disorders. Neurosci Biobehav Rev 2019; 105: 212-9.
9 Poppe A, Tiles Sar N, Konings SRA, e.a. Moving from supported to independent living. Soc Psychiatry Psychiatr Epidemiol 2024; 59: 1243-54.
10 McGorry P, Keshavan M, Goldstone S, e.a. Biomarkers and clinical staging in psychiatry. World Psychiatry 2014; 13: 211-23.
11 Mollon J, David AS, Zammit S, e.a. Course of cognitive development. JAMA Psychiatry 2018; 75: 270-9.
12 Sheffield JM, Karcher NR, Barch DM. Cognitive deficits in psychotic disorders: a lifespan perspective. Neuropsychol Rev 2018; 28: 509-33.
13 Fusar Poli P, Deste G, Smieskova R, e.a. Cognitive functioning in prodromal psychosis. Arch Gen Psychiatry 2012; 69: 562-71.
14 Van Donkersgoed RJ, Wunderink L, Nieboer R, e.a. Social cognition in individuals at ultra high risk. PLoS One 2015; 10: e0141075.
15 Simon AE, Cattapan Ludewig K, Zmilacher S, e.a. Cognitive functioning in the schizophrenia prodrome. Schizophr Bull 2007; 33: 761-71.
16 Seidman LJ, Giuliano AJ, Meyer EC, e.a. Neuropsychology of the prodrome to psychosis. Arch Gen Psychiatry 2010; 67: 578-88.
17 McCleery A, Nuechterlein KH. Cognitive impairment in psychotic illness. Dialogues Clin Neurosci 2019; 21: 239-48.
18 Rund BR, Barder HE, Evensen J, e.a. Neurocognition and duration of psychosis. Schizophr Bull 2016; 42: 87-95.
19 Bonner Jackson A, Grossman LS, Harrow M, e.a. Neurocognition in schizophrenia. Compr Psychiatry 2010; 51: 471-9.
20 Fett AJ, Velthorst E, Reichenberg A, e.a. Long term changes in cognitive functioning. JAMA Psychiatry 2020; 77: 387-96.
21 Zanelli J, Mollon J, Sandin S, e.a. Cognitive change in schizophrenia. Am J Psychiatry 2019; 176: 811-9.
22 Trubetskoy V, Pardiñas AF, Qi T, e.a. Mapping genomic loci implicates genes. Nature 2022; 604: 502-8.
23 McCutcheon RA, Keefe RSE, McGuire PK. Cognitive impairment in schizophrenia. Mol Psychiatry 2023; 28: 1902-18.
24 Blokland GAM, Mesholam Gately RI, Toulopoulou T, e.a. Heritability of neuropsychological measures. Schizophr Bull 2017; 43: 788-800.
25 Gur RE, Moore TM, Rosen AFG, e.a. Association of lifetime exposure to traumatic events. JAMA Psychiatry 2019; 76: 351-60.
26 Voineskos AN, Hawco C, Neufeld NH, e.a. Functional magnetic resonance imaging. World Psychiatry 2024; 23: 26-51.
27 Van Erp TG, Hibar DP, Rasmussen JM, e.a. Subcortical brain volume abnormalities. Mol Psychiatry 2016; 21: 585-92.
28 Van Erp TGM, Walton E, Hibar DP, e.a. Cortical brain abnormalities. Biol Psychiatry 2018; 84: 644-54.
29 Khalil M, Hollander P, Raucher Chéné D, e.a. Structural brain correlates of cognitive function. Neurosci Biobehav Rev 2022; 132: 37-49.
30 Penadés R, Franck N, González Vallespí L, e.a. Neuroimaging studies of cognitive function. Adv Exp Med Biol 2019; 1118: 117-34.
31 Sheffield JM, Karcher NR, Barch DM. Cognitive deficits in psychotic disorders: a lifespan perspective. Neuropsychol Rev 2018; 28: 509-53.
32 Garety PA, Howes OD, Beards S, e.a. The development of a biopsychosocial model of psychosis. Psychol Med 2007; 37: 495-505.
33 Cools R, D’Esposito M. Inverted U shaped dopamine actions on human working memory and cognitive control. Biol Psychiatry 2011; 69: e113-25.
34 Nieoullon A. Dopamine and the regulation of cognition and attention. Prog Neurobiol 2002; 67: 53-83.
35 Carruthers SP, Gurvich CT, Rossell SL. The muscarinic system, cognition and schizophrenia. Neurosci Biobehav Rev 2015; 55: 393-402.
36 Lewis DA, Hashimoto T, Volk DW. Cortical inhibitory neurons and schizophrenia. Nat Rev Neurosci 2005; 6: 312-24.
37 Vermeulen JM, Schirmbeck F, Blankers M, e.a. Genetic Risk and Outcome of Psychosis (GROUP) investigators. Association between smoking behavior and cognitive functioning in patients withpsychosis, siblings, and healthy control subjects: results from a prospective 6-year follow-up study. Am J Psychiatry 2018; 175: 1121-8.
38 Bosma MJ, Marsman M, Vermeulen JM, e.a. Exploring the interactions between psychotic symptoms, cognition, and environmental risk factors: A Bayesian analysis of networks. Schizophr Bull 2025; 7: 1134-45.
39 Nuechterlein KH, Green MF, Kern RS, e.a. The MATRICS Consensus Cognitive Battery, part 1: test selection, reliability, and validity. Am J Psychiatry 2008; 165: 203-13.
40 Van Alphen S, Ammeraal M, Blanke C, e.a. Multidisciplinaire richtlijn Schizofrenie. Utrecht: De Tijdstroom; 2012. https://www.trimbos.nl/docs/0d648a6d-5847-4168-bc30-4d3e55fc8de7.pdf
41 Ventura J, Reise SP, Keefe RS, e.a. The Cognitive Assessment Interview (CAI). Schizophr Res 2010; 121: 24-31.
42 Lee M, Cernvall M, Borg J, e.a. Cognitive function and variability in antipsychotic drug naive patients with first episode psychosis: a systematic review and meta analysis. JAMA Psychiatry 2024; 81: 468-76.
43 Barbui C, Nosè M, Bindman J, e.a. Sex differences in the subjective tolerability of antipsychotic drugs. J Clin Psychopharmacol 2005; 25: 521-26.
44 Wunderink L, Nieboer RM, Wiersma D, e.a. Recovery in remitted first episode psychosis. JAMA Psychiatry 2013; 70: 913-20.
45 Faber G, Smid HG, van Gool AR, e.a. The effects of guided discontinuation of antipsychotics on neurocognition in first onset psychosis. Eur Psychiatry 2012; 27: 275-80.
46 Begemann MJH, Thompson IA, Veling W, e.a. To continue or not to continue? Antipsychotic medication maintenance versus dose reduction/discontinuation in first episode psychosis: HAMLETT, a pragmatic multicenter single blind randomized controlled trial. Trials 2020; 21: 147.
47 Moncrieff J, Crellin N, Stansfeld J, e.a. Antipsychotic dose reduction and discontinuation versus maintenance treatment in people with schizophrenia and other recurrent psychotic disorders in England (the RADAR trial): an open, parallel group, randomised controlled trial. Lancet Psychiatry 2023; 10: 848-59.
48 Tani H, Takasu S, Uchida H, e.a. Factors associated with successful antipsychotic dose reduction in schizophrenia: a systematic review of prospective clinical trials and meta analysis of randomized controlled trials. Neuropsychopharmacology 2020; 45: 887-901.
49 Allott K, Schäfer MR, Thompson A, e.a. Cognitive outcomes following antipsychotic dose reduction. Schizophr Bull 2023: 883.
50 Feber L, Peter NL, Chiocchia V, e.a. Antipsychotic drugs and cognitive function. JAMA Psychiatry 2025; 82: 47-56.
51 Van Dijk F, de Wit I, Blankers M, e.a. The Personal Antipsychotic Choice Index. Pharmacopsychiatry 2018; 51: 89-99.
52 Haddad C, Salameh P, Sacre H, e.a. Effects of antipsychotic and anticholinergic medications. BMC Psychiatry 2023; 23: 61.
53 Bowie CR, Bell MD, Fiszdon JM, e.a. Cognitive remediation for schizophrenia: an expert working group white paper. Schizophr Res 2020; 215: 49-53.
54 Allott K, van der El K, Bryce S, e.a. Compensatory interventions for cognitive impairments. Schizophr Bull 2020; 46: 869-83.
55 Barlati S, Deste G, De Peri L, e.a. Cognitive remediation in schizophrenia: current status and future perspectives. Schizophr Res Treatment. 2013;2013:156084.
56 Wykes T, Huddy V, Cellard C, e.a. A meta analysis of cognitive remediation for schizophrenia. Am J Psychiatry 2011; 168: 472-85.
57 Stiekema APM, van Dam MT, Bruggeman R, e.a. Facilitating recovery of daily functioning. Schizophr Bull 2020; 46: 1259-68.
58 Vita A, Barlati S, Ceraso A, e.a. Acceptability of cognitive remediation for schizophrenia. Psychol Med 2023; 53: 3661-71.
59 Velligan DI, Bow Thomas CC, Huntzinger C, e.a. Randomized controlled trial of the use of compensatory strategies to enhance adaptive functioning in outpatients with schizophrenia. Am J Psychiatry 2000; 157: 1317-23.
60 Nijman SA, Veling W, van der Stouwe ECD, e.a. Social cognition training for people with a psychotic disorder: a network meta analysis. Schizophr Bull 2020; 46: 1086-103.
61 Vita A, Gaebel W, Mucci A, e.a. European Psychiatric Association guidance on treatment of cognitive impairment in schizophrenia. Eur Psychiatry 2022; 65: e57.
62 Firth J, Stubbs B, Rosenbaum S, e.a. Aerobic exercise improves cognitive functioning in people with schizophrenia: a systematic review and meta analysis. Schizophr Bull 2017; 43: 546-56.
63 Keefe RS, Poe M, Walker TM, e.a. The Schizophrenia Cognition Rating Scale: an interview based assessment and its relationship to cognition, real world functioning, and functional capacity. Am J Psychiatry 2006; 163: 426 32.
64 Reeder C, Huddy V, Cella M, e.a. A new generation computerised metacognitive cognitive remediation programme for schizophrenia (CIRCuiTS): a randomised controlled trial. Psychol Med 2017; 47: 2720 30.
Authors
Marieke Pijnenborg, hoogleraar Klinische neuropsychologie, gz-psycholoog, vakgroep Klinische en Ontwikkelingsneuropsychologie, faculteit Gedrags- en Maatschappijwetenschappen, Rijksuniversiteit Groningen; Psychosecircuit, Langdurige Zorg, GGZ Drenthe, Assen.
Nynke Boonstra, hoogleraar Verpleegkunde in de ggz, divisie Hersenen, UMC Utrecht, Utrecht; verpleegkundig specialist GGZ, KieN VIP, Leeuwarden; lector onderzoeksgroep Zorg & Innovatie in de Psychiatrie, NHL Stenden hogeschool, Leeuwarden.
Lieuwe de Haan, hoogleraar Psychotische stoornissen, psychiater, afd. Psychiatrie, Early Psychosis Section, Amsterdam UMC, Universiteit van Amsterdam.
Lisette van der Meer, universitair hoofddocent, psycholoog, Vakgroep Klinische en ontwikkelingsneuropsychologie, Faculteit Gedrags- en Maatschappijwetenschappen, Rijksuniversiteit Groningen; Cluster Langdurige Zorg en Wonen, Lentis, Zuidlaren.
Correspondentie
Prof. dr. G.H.M. Pijnenborg (g.h.m.pijnenborg@rug.nl).
Geen strijdige belangen gemeld.
Het artikel werd voor publicatie geaccepteerd op 6-10-2025.
Citeren
Tijdschr Psychiatr. 2026;68(1):32-38
