ECT in patients with deep brain stimulation: The first cases in the Netherlands
Electroconvulsive therapy (ECT) is among the most effective treatments for severe depression. However, there is a lack of research regarding its safety and efficacy in patients with deep brain stimulation (DBS). While the available clinical data does not indicate safety concerns, clinicians are often cautious due to theoretical risks and manufacturer warnings. However with a growing number of patients receiving DBS, the group that could benefit from ECT is expanding. In this report, we present the first two cases in the Netherlands in which ECT was administered to patients with DBS. Our findings suggest that ECT can be safely and effectively administered when the DBS system is switched off during ECT-stimulus. Clinically, this means that these patients should not be excluded from ECT but instead referred to specialized centers for evaluation and care.
Elektroconvulsietherapie (ECT) is een van de meest effectieve en grondig onderzochte behandelingen voor depressie. Meer dan 70% van de patiënten bereikt respons en de helft remissie.1 Bij ECT wordt onder narcose een gegeneraliseerd insult opgewekt met een elektrische stimulus op het hoofd. Vanwege deze procedure rijst de vraag of ECT veilig en effectief is met implantaten in het brein, zoals bij diepe hersenstimulatie (deep brain stimulation, DBS).2-4
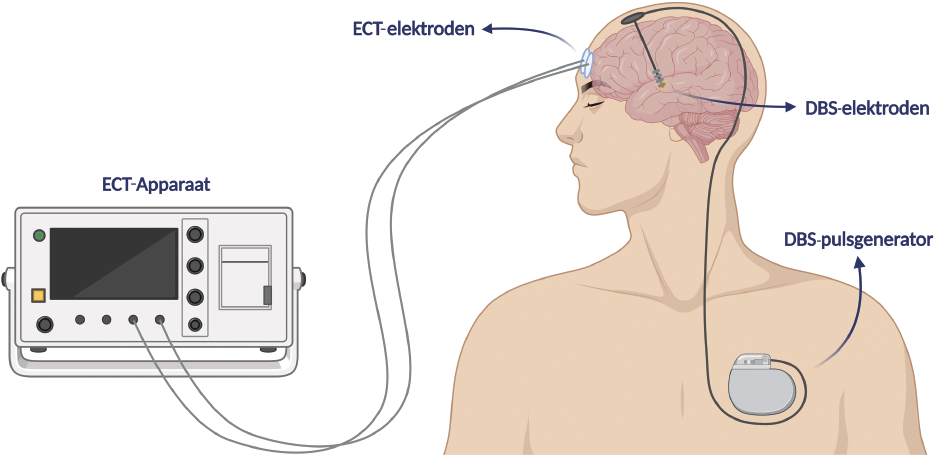
DBS is een multidisciplinaire behandeling die wordt toegepast bij neurologische en psychiatrische stoornissen, zoals de ziekte van Parkinson, obsessieve-compulsieve stoornis en therapieresistente depressie (TRD).5 Tijdens een DBS-operatie worden twee hersenelektroden in diepgelegen structuren geplaatst. De locatie is afhankelijk van de aandoening. De elektroden moduleren disfunctionerende hersennetwerken intracerebraal en continu, met elektrische pulsen afkomstig uit een pulsgenerator die bij de borstspier wordt geïmplanteerd (figuur 1). Het systeem blijft voor de rest van het leven in situ.6 In de maanden na de operatie worden de effectiefste instellingen gezocht in samenwerking tussen de patiënt en een multidisciplinair behandelteam. Bij psychiatrische indicaties is de psychiater hoofdbehandelaar.
Figuur 1. Schematische weergave van een geïmplanteerd DBS-systeem en bifrontale ECT-elektrodeplaatsing
Het aantal mensen met DBS is groot en stijgt. Per jaar worden in Nederland 300-350 DBS-operaties uitgevoerd en zijn er naar schatting 2000-2500 patiënten met DBS.7 Dit zal toenemen aangezien de bevolking vergrijst en het aantal indicaties groeit.5 Verder is de kans dat deze populatie een ECT-indicatie krijgt verhoogd: naast de psychiatrische indicaties zoals obsessieve-compulsieve stoornis gaat ook de dominante indicatie voor DBS, ziekte van Parkinson, gepaard met een verhoogde kans op comorbide depressie (prevalentie: 22,9%).8-10 Daarnaast wordt DBS steeds vaker gebruikt voor de behandeling van TRD; ook in Nederland.11,12
Sommige van deze patiënten kiezen voor DBS terwijl ze met succes behandeld worden met onderhouds-ECT, maar last hebben van bijwerkingen. Hoewel de responspercentages van DBS veelbelovend zijn (56% respons en 35% remissie), bestaat kans op onvoldoende DBS-effect.13 Dit maakt de mogelijkheid van ECT met DBS in situ, voor deze groep zonder verdere behandelopties, een belangrijke klinische overweging.
Kennis over effectiviteit en veiligheid van ECT bij patiënten met DBS wordt dus steeds relevanter. Alhoewel fabrikanten afraden om ECT toe te passen bij patiënten met DBS, werd in een recente systematische review (26 casussen) geconcludeerd dat er geen interactie is tussen ECT en DBS.14,15 Op basis van de (beperkte) praktijkdata lijkt ECT bij DBS dus veilig.
Om de veiligheid en de effectiviteit van ECT bij patiënten met DBS verder te exploreren en best practices te delen, beschrijven wij de eerste twee casussen in Nederland waar ECT is toegepast bij patiënten met DBS. Vervolgens bespreken we onze praktijkervaring in de context van de bredere literatuur.
Casusbeschrijvingen
Patiënte A, een 66-jarige vrouw, werd opgenomen op de medisch-psychiatrische unit na een suïcidale geste bij een depressie met psychotische kenmerken. Patiënte had sinds 2014 de ziekte van Parkinson waarvoor zij behandeld werd met DBS. Alhoewel DBS haar motorische symptomen had verbeterd, bleven er hinderlijke loopproblemen bestaan die als functioneel neurologisch werden geduid. Hiernaast kreeg zij progressieve angst en somberheid bij een blanco psychiatrische voorgeschiedenis. Uiteindelijk ontstond een euthanasiewens vanuit uitzichtloosheid bij nihilisme, passend bij een psychotische depressie.
Patiënte werd behandeld in samenwerking met de afdeling Neurologie en Neurochirurgie. Ondanks behandeling conform de multidisciplinaire richtlijn voor depressie trad zes maanden na start een verslechtering op. Medicamenteus waren venlafaxine en clomipramine gestaakt wegens onvoldoende effect en gebruikte zij nortriptyline (spiegels: 130 μg/l) met clozapineadditie (alle in adequate dosering en voor adequate duur) en oxazepam (0-15 mg/dag) zo nodig. Parkinsonmedicatie bestond uit levodopa/carbidopa (0-100 mg/25 mg per dag) en ropinirol (2-6 mg/dag). Psychotherapeutisch volgde zij het dagbehandelingsprogramma voor depressie met onder andere cognitieve gedragstherapie.
Bij uitblijvend effect werd na multidisciplinair overleg geconcludeerd dat ECT een goede vervolgstap kon zijn. Patiënte en familie waren initieel terughoudend gezien haar voorkeur voor euthanasie en gebrek aan evidentie voor de effectiviteit en veiligheid bij patiënten met DBS. Na een second opinion en uitvoerig overleg ontstond uiteindelijk overeenstemming om ECT uit te voeren.
Voor ECT werd de Thymatron system IV gebruikt, op het reguliere programma genaamd ‘DGX’. We kozen voor bifrontale elektrodeplaatsing. De dag vóór ECT werden benzodiazepinen vervangen door promethazine. Om toename van motorische symptomen door het uitzetten van DBS te voorkomen, werd ná de inductie van de anesthesie het DBS-systeem naar 0 volt teruggebracht en vervolgens uitgezet. Direct na de stimulus werd het systeem weer aangezet. De impedanties van het DBS-systeem werden voor en na de ECT gemeten. Na prikkeldrempelbepaling werd conform lokaal ECT-protocol tweewekelijks behandeld op 60% (pulsbreedte 1,0 ms, frequentie 70 Hz, 336 pulsen over 1,6 s, charge 203 mC, 60 J (op 220 Ω)). Anesthesiologisch werd gebruikgemaakt van etomidaat (12-20 mg) en suxamethonium (75 mg). Gezien het effect van benzodiazepinegebruik op de insultdrempel werd flumazenil 0,5 mg gegeven.
Vóór ECT had patiënte een zeer ernstige psychotische depressie (Hamilton Depressie Schaal (HDRS): 33) en na de vijfde ECT-sessie werd volledige remissie gezien (HDRS-score: 3), waarbij patiënte zich niet meer kon voorstellen dat zij eerder euthanasie wilde. Na 9 sessies werd ECT gestaakt, maar 2 weken daarna ontstond een terugval. Hierop werd onderhouds-ECT (om de week) gestart om remissie te behouden. Uiteindelijk werd lithium toegevoegd aan de behandeling, waarmee onderhouds-ECT gestaakt kon worden. Patiënte kreeg in totaal 26 ECT-sessies.
Bijwerkingen betroffen inprentingsstoornissen en spierpijn. Het effect van de DBS op haar motorische klachten veranderde (ook op de lange termijn) niet. Cognitieve bijwerkingen werden met neuropsychologisch onderzoek geobjectiveerd. Afgenomen tests: 15-woordentest (geheugen), cijferreeksen (werkgeheugen), Columbia University Autobiographical Memory Interview (autobiografisch geheugen), Trail Making Test, Stroop test (aandacht en executief functioneren), en Fluency (taal, semantisch geheugen en executief functioneren). Vóór ECT was patiënte moeilijk testbaar en had zij verlaagde scores in aandacht, geheugen en executieve functies. Tien dagen na de eerste ECT-serie was dit evident verbeterd, al werd nog wel een beperking gemeten in de autobiografische herinnering, uitgestelde herinnering en verdeelde aandacht (geduid bij de ziekte van Parkinson).
Drie maanden na de definitieve stop van ECT scoorde patiënt normaal voor haar leeftijd en opleidingsniveau. Ook psychomotorische snelheid nam duidelijk toe, van zeer laag (percentiel 0) tot (laag)gemiddeld (percentiel 18). De enige beperking betrof het autobiografische geheugen aangaande de periode voorafgaand en tijdens de ECT; een bekende cognitieve bijwerking van ECT.16
Patiënte B, een 67-jarige vrouw, werd opgenomen met acuut verhoogde suïcidaliteit. Sinds haar 20ste had zij een recidiverende depressieve stoornis. Zij was behandeld met verschillende psychotherapeutische trajecten, 16 verschillende medicamenteuze strategieën en tweemaal eerder met een ECT-serie. De eerste serie had redelijk succes, maar daarna bleef de ECT zonder effect. In 2014 nam zij deel aan een studie waarin DBS voor depressie werd toegepast.17 Hierbij werden de DBS-elektroden in het voorste gedeelte van de capsula interna (ventral anterior limb of the internal capsule, vALIC) geïmplanteerd, met langdurig goed effect. Een recidief in 2022 werd behandeld met esketamine en psychologische ondersteuning met wisselend effect.
Bij opname rapporteerde zij een sombere stemming, anhedonie, spanning en suïcidaliteit. Haar medicatie was: quetiapine (330 mg), sertraline (150 mg) en diazepam (20 mg) zo nodig. Dit werd geswitcht en verhoogd tot 0-6 mg lorazepam dag. Intensivering van de esketaminebehandeling bleek onvoldoende effectief. Verhoging van DBS-instellingen had onrust als bijwerking en patiënte was bang nog verder terug te vallen bij verandering van deze instellingen.
Er werd een indicatie gezien voor ECT en we kozen daarbij voor bifrontale elektrodeplaatsing, met hetzelfde systeem als bij patiënte A. Benzodiazepinen werden de dag voor ECT vervangen door promethazine. Vóór inductie van de anesthesie werd de DBS naar 0 volt teruggebracht, daarna uitgezet en na de stimulus weer aangezet. De impedanties van het DBS-systeem lieten geen afwijkingen zien. Bij inadequate insulten tijdens prikkeldrempelbepaling tot 80% werd besloten te stimuleren op 200%. De pulsbreedte bedroeg 1,0 ms, frequentie 70 Hz, 1120 pulsen over 8 s, charge 1008 mC, 200 J (op 220 Ω). Later in het traject werd de prikkeldrempel opnieuw bepaald, dit leidde tot stimulatie op 120%. Anesthesiologisch werd gebruikgemaakt van etomidaat (14-40 mg) en suxamethonium (100 mg). In verband met benzodiazepinegebruik werd ook flumazenil 0,5 mg gegeven.
Na 4 sessies verbeterde de stemming en verminderde de suïcidaliteit. De HDRS-score daalde na 6 sessies van 22 naar 11. Na 9 sessies waren de klachten in vroege remissie en werd de frequentie verlaagd naar één keer per week. Na 13 sessies werd de ECT gestaakt omdat stabiele remissie bereikt was, waarbij ook de suïcidaliteit volledig verdwenen was. Helaas ontstond na 7 weken een terugval, waarop de ECT werd herstart. Ten tijde van schrijven werd patiënte nog behandeld middels (onderhouds-)ECT.
Qua bijwerkingen was er sprake van inprentingsstoornissen. Uit neuropsychologisch onderzoek (zie de eerste casus voor afgenomen tests) voorafgaand en twee weken na afloop van de eerste ECT-serie kwamen geen cognitieve stoornissen naar voren.
Bespreking
Wij beschrijven de eerste twee casussen van patiënten met DBS die in Nederland zijn behandeld met ECT. De bevindingen zijn van direct belang voor de klinische praktijk, aangezien vergelijkbare situaties vaker zullen voorkomen door de toename van DBS en een verhoogd risico op depressie bij DBS-indicaties. Beide patiënten kregen een succesvolle, ongecompliceerde ECT-serie waarbij de werking en bijwerkingen niet afweken van die bij reguliere ECT.
Deze bevindingen komen overeen met de internationale literatuur.15 Om geen recente publicaties te missen, breidden we de zoekopdracht van een recente systematische review uit in PubMed (t/m 28 augustus 2024) onder de termen (‘ECT’ OR ‘electroconvulsive’) AND (‘DBS’ OR ‘deep brain stimulation’), wat één aanvullende casus opleverde.15,18 Ook werd één casus buiten PubMed gevonden.19 In totaal is gepubliceerd over 28 patiënten (8 met onderhouds-ECT), van wie er 16 de ziekte van Parkinson hadden en 4 TRD. Onze casus van patiënte B betreft de eerste casus over ECT bij vALIC-DBS voor TRD. Aangezien alle beschikbare literatuur casusbeschrijvingen betreft, is er zeer waarschijnlijk sprake van publicatiebias. Voor toekomstig onderzoek is het dan ook belangrijk om effectiviteit en veiligheid systematisch te onderzoeken in een prospectieve cohortstudie.
Onze bevindingen komen niet overeen met de adviezen van DBS-fabrikanten. Zowel op de website als bij navraag door twee coauteurs, wordt afgeraden ECT toe te passen omdat de veiligheid onvoldoende onderzocht is.14 Theoretische gronden hiervoor zijn de kans op opwarming (of anderszins disfunctioneren) van de DBS-elektroden, vasculaire complicaties of verlengde insulten/status epilepticus.4 Voor geen van deze theoretische risico’s hebben wij aanwijzingen gevonden in de kliniek of de literatuur.15,18,19 Het DBS-systeem liet in beide casussen geen afwijkende impedanties of andere tekenen van disfunctioneren zien. In 7 casussen is voor en na ECT beeldvorming verricht zonder aanwijzingen voor verplaatsingen.15 Wij hebben helaas motorische klachten niet geobjectiveerd met een gestandaardiseerd meetinstrument, maar de literatuur suggereert dat klachten van de DBS-indicatie doorgaans verbeteren of stabiel blijven.15 Een belangrijke kanttekening aangaande de veiligheid is dat specifieke, objectieve metingen van temperatuur of vasculatuur (met MRI vóór en na ECT) ontbreken. Dit is een belangrijk punt voor toekomstig onderzoek.
We hebben gekozen voor een bifrontale ECT-elektrodeplaatsing om zo ver mogelijk van DBS-elektroden af te stimuleren. Alhoewel dit het meest gangbaar is in de literatuur, lijkt het geen vereiste. Er zijn in totaal 11 casussen met bitemporale plaatsing gerapporteerd en 3 casussen met rechts-unilaterale plaatsing. Er zijn verder enkele casussen gerapporteerd waarin is gekozen de ECT-elektroden zo ver mogelijk van de boorgaten en het fixatiemateriaal af te plaatsen (in tegenstelling tot de DBS-elektroden).15,20 De rationale hierachter is dat de boorgaten theoretisch het elektrische veld van de ECT-stimulus kunnen veranderen, al lijken deze veranderingen niet groot genoeg voor klinische relevantie.3
Behoudens de bifrontale elektrodeplaatsing, het uitzetten van de DBS en het meten van DBS-impedanties was de ECT-procedure gelijk aan die bij patiënten zonder DBS. Hoewel bifrontale elektrodeplaatsing in Nederland minder gangbaar is dan rechts-unilateraal of bitemporaal, is deze niet minder effectief gebleken in een vergelijkende meta-analyse.21 Ook is het nog de vraag of het noodzakelijk is het DBS-systeem uit te schakelen: in één casus is dit niet gedaan, wat ongecompliceerd verliep.20 Wij hebben pragmatisch gekozen voor uitschakelen omdat hierover meer data beschikbaar zijn.
Het mag duidelijk zijn dat de gehanteerde methode gebaseerd is op beperkte data en ervaring en niet als sluitend advies beschouwd moet worden. Wel hopen wij met deze suggesties (zie tabel 1 voor een overzicht) een uitgangspunt te bieden voor behandelaren in gelijksoortige situaties en bij te dragen aan de verdere ontwikkeling van een veilige procedure voor ECT bij patiënten met DBS.
Tabel 1. Gebruikte aanvullingen op de reguliere ECT-procedure
|
Voorbereidingen |
|
|
– Consultatie van een gespecialiseerd, multidisciplinair DBS-team – DBS-systeem kortdurend uitzetten (enkele minuten) om eventuele klinische effecten hiervan te observeren – Uitgebreide voorlichting aan patiënt en naasten – Uitgangsmeting voor de klachten van de ECT-indicatie én voor de klachten van de DBS-indicatie |
|
|
ECT-procedure |
|
|
Vlak vóór de inleiding |
Door (of onder supervisie van) (verpleegkundig) DBS-specialist: – Impedanties DBS-systeem meten – DBS-systeem instellen op 0,0 V – DBS-systeem uitzetten |
|
ECT-stimulus |
– Kies een ECT-elektrodeplaatsing (meestal bifrontaal) waarbij rekening gehouden wordt met de DBS-elektroden (zo ver mogelijk er vandaan) |
|
Direct ná de stimulus |
Door (of onder supervisie van) (verpleegkundig) DBS-specialist: – Impedanties DBS-systeem meten – DBS-systeem aanzetten – Pre-ECT-instellingen van DBS-systeem herstellen |
|
Na ECT |
|
|
– Monitoren van klachten DBS-indicatie – Monitoren van bijwerkingen van ECT – Bevindingen systematisch vastleggen en publiceren |
|
Conclusie
Op basis van onze klinische ervaring en de beschikbare literatuur lijkt DBS op voorhand geen absolute contra-indicatie te vormen voor ECT. Ondanks de theoretische risico’s op aanzienlijke complicaties en een negatief advies van de DBS-fabrikanten suggereren onze bevindingen dat ECT veilig en effectief kan worden toegepast bij patiënten met DBS. Dit is echter gebaseerd op beperkte data bestaande uit 30 casussen, met kans op publicatiebias. Om de risico’s adequaat af te wegen zijn goede klinische indicatiestelling, nauwe monitoring en consultatie van multidisciplinaire teams met ervaring met DBS, stemmingsstoornissen en ECT vereist. Behoudens de plaatsing van de ECT-elektroden, het uitzetten van de DBS tijdens de stimulus en het doormeten van de impedanties van het DBS-systeem, blijft de ECT-procedure nagenoeg gelijk aan die bij patiënten zonder DBS.
Literatuur
1 Van Diermen L, Van Den Ameele S, Kamperman AM, e.a. Prediction of electroconvulsive therapy response and remission in major depression: Meta-analysis. Br J Psychiatry 2018; 212: 71-80.
2 Gursky JT, Rummans TA, Black JL. ECT administration in a patient after craniotomy and gamma knife surgery: A case report and review. J ECT 2000; 16: 295-9.
3 Deng Z De, Hardesty DE, Lisanby SH, e.a.. Electroconvulsive therapy in the presence of deep brain stimulation implants: Electric field effects. 2010 Annu Int Conf IEEE Eng Med Biol Soc 2010; 2010: 2049-52.
4 Gahr M, Connemann BJ, Freudenmann RW, e.a.. Safety of electroconvulsive therapy in the presence of cranial metallic objects. J ECT 2014; 30: 62-8.
5 Harmsen IE, Wolff Fernandes F, Krauss JK, e.a. Where are we with deep brain stimulation? A review of scientific publications and ongoing research. Stereotact Funct Neurosurg 2022: 1-14.
6 Temel Y, Leentjens AFG, de Bie RMA, e.a. Fundamentals and clinics of deep brain stimulation – An interdisciplinary approach. Cham: Springer; 2020.
7 Schuurman PR, Temel Y, van Vugt JPP, e.a. Behoefteraming deep brain stimulation. /www.eerstekamer.nl/overig/20190813/behoefteraming_deep_brain/document
8 Mocking RJT, Ackermans L, Bergfeld IO, e.a. Consensusverklaring diepe hersenstimulatie bij obsessieve-compulsieve stoornis. Tijdschr Psychiatr 2024; 66: 387-94.
9 Goodarzi Z, Mrklas KJ, Roberts DJ, e.a. Detecting depression in Parkinson disease. Neurology 2016; 87: 426-37.
10 Chikatimalla R, Dasaradhan T, Koneti J, e.a. Depression in Parkinson’s disease: A narrative review. Cureus 2022; 14: e27750.
11 Dandekar MP, Fenoy AJ, Carvalho AF, e.a. Deep brain stimulation for treatment-resistant depression: An integrative review of preclinical and clinical findings and translational implications. Mol Psychiatry 2018; 23: 1094-112.
12 Hitti FL, Yang AI, Cristancho MA, e.a. Deep brain stimulation is effective for treatment-resistant depression: a meta-analysis and meta-regression. J Clin Med 2020; 9: 2796.
13 Wu Y, Mo J, Sui L, e.a. Deep brain stimulation in treatment-resistant depression: a systematic review and meta-analysis on efficacy and safety. Front Neurosci 2021;15: 655412.
14 Medtronic. Indications, safety, and warnings deep brain stimulation therapy. https://europe.medtronic.com/xd-en/healthcare-professionals/therapies-procedures/neurological/deep-brain-stimulation/indications-safety-warnings.html
15 Bukowski N, Laurin A, Laforgue EJ, e.a. Efficacy and safety of electroconvulsive therapy in patients with deep brain stimulation: literature review, case report for patient with essential tremor, and practical recommendations. J ECT 2022; 38: E29-40.
16 Sackeim HA. Autobiographical memory and electroconvulsive therapy: final thoughts on the bathwater. J ECT 2014; 30: 189-90.
17 Bergfeld IO, Ooms P, Lok A, e.a. Efficacy and quality of life after 6-9 years of deep brain stimulation for depression. Brain Stimul 2022; 15: 957-64.
18 Gherman BR, Prieto BR, Barcia JA, e.a. Safety and efficacy of electroconvulsive therapy in a patient with four deep brain stimulation electrodes. J ECT 2023; 39: 71-5.
19 Lucardie A, Van Diermen L, Madani Y, e.a. Electroconvulsive therapy for psychotic depression in a patient with a deep brain stimulator: A case report. Psychiatry Res Case Reports 2023; 2: 100193.
20 Vila-Rodriguez F, McGirr A, Tham J, e.a. Electroconvulsive therapy in patients with deep brain stimulators. J ECT 2014; 30: 16-8.
21 Dunne RA, McLoughlin DM. Systematic review and meta-analysis of bifrontal electroconvulsive therapy versus bilateral and unilateral electroconvulsive therapy in depression. World J Biol Psychiatry 2012; 13: 248-58.
Authors
Gosse Mol, aios psychiatrie.
Taco Goedemans, aios psychiatrie.
Sonja Rutten, psychiater.
Isidoor Bergfeld, psycholoog i.o. tot GZ-psycholoog.
Marloes Oudijn, psychiater.
Floor de Wit, verpleegkundige.
Laurien Aben, klinisch neuropsycholoog.
Dominique Scheepens, psychiater.
Karel Scheepstra, psychiater.
Eva Puts, verpleegkundige.
Vincent Odekerken, neuroloog.
Rosanne Prins, verpleegkundig specialist neurologische bewegingsstoornissen.
Maarten Bot, neurochirurg.
Pepijn van den Munckhof, neurochirurg.
Anja Lok, psychiater.
Roel Mocking, psychiater*.
Allen werkzaam bij Amsterdam UMC.
*Mede namens: Jerry Hendriks, Nanne de Vries, Nora Runia en Damiaan Denys.
Correspondentie
Gosse Mol (g.j.j.mol@amsterdamumc.nl).
Geen strijdige belangen gemeld.
Het artikel werd voor publicatie geaccepteerd op 17-2-2025.
Citeren
Tijdschr Psychiatr. 2025;67(5):291-295
