Fahr’s disease and mania: case report and literature review
Fahr’s disease is a rare neurodegenerative disorder characterized by symmetrical calcifications of the basal ganglia. Fahr’s disease is categorized as a neurodegenerative condition due to the pathophysiological effects of calcification. The condition can be associated with a range of neuropsychiatric, motor, and cognitive symptoms. We report a 38-year-old man with mania with psychotic features. Neurological examination showed a bilateral tremor in the hands. Imaging revealed calcifications in the basal ganglia, consistent with Fahr’s disease. He was successfully treated with olanzapine and lithium, but developed extrapyramidal symptoms, which responded well to procyclidine.
The risk of extrapyramidal symptoms and neuroleptic malignant syndrome is increased in Fahr’s disease, necessitating cautious use of antipsychotic medications. The complex symptomatology and incomplete penetrance of Fahr’s disease may contribute to underdiagnosis. This case highlights the value of brain imaging in cases of severe atypical psychiatric symptoms.
De ziekte van Fahr is een zeldzame neurodegeneratieve aandoening die wordt veroorzaakt door bilaterale, symmetrische verkalkingen in de basale ganglia. De aandoening wordt gekenmerkt door een breed scala aan neurologische en psychiatrische symptomen, zoals angst, psychose, depressie, motorische en cognitieve stoornissen. De ziekte wordt vermoedelijk ondergediagnosticeerd door de complexiteit van de diagnose met een breed spectrum van klinische manifestaties.1
De exacte prevalentie is moeilijk te achterhalen, maar in de beperkte literatuur die er is, schat men het vóórkomen van calcificaties in de basale ganglia, op basis van beeldvormingsstudies, op 0,93%.2 Slechts een deel van de betreffende patiënten krijgt echter symptomen, waarbij het nog onduidelijk is hoeveel procent zich initieel met psychiatrische dan wel neurologische symptomen meldt. In een beschrijving van 62 patiënten werd het percentage patiënten die zich initieel met psychiatrische symptomen meldden, geschat op 40%.3 Dit toont de relevantie van deze onderbelichte aandoening aan voor psychiaters.
De ziekte werd voor het eerst beschreven in 1930 door Karl Theodor Fahr, in een casusbeschrijving van een man met epilepsie en symmetrische verkalkingen van de basale ganglia en de cerebrale cortex.4 De primaire vorm wordt, behalve de ziekte van Fahr, ook idiopathische basale-gangliacalcificatie (IBGC) of primaire familiale hersencalcificatie (PFBC) genoemd, waarbij verschillende genetische mutaties zijn geïdentificeerd.5 De diagnose van de ziekte van Fahr vereist de uitsluiting van secundaire oorzaken van calcificaties, zoals endocriene aandoeningen (meestal hypoparathyreoïdie), infecties of blootstelling aan toxische stoffen (bijv. lood).6 Voor secundaire vormen van calcificaties in de hersenen werd de term syndroom van Fahr voorgesteld.6
CASUSBESCHRIJVING
Patiënt A, een 38-jarige verpleegkundige, werd opgenomen op de psychiatrische crisisafdeling met paranoïde en megalomane wanen. De symptomen ontwikkelden zich geleidelijk over enkele maanden. Patiënt vertoonde een toename in activiteit en extraversie en begon ambitieuze zakelijke plannen te maken. Hij had de indruk dat mensen hem tegenwerkten en dat hij online bedreigingen kreeg over zijn bedrijf.
Bij psychiatrisch onderzoek toonde patiënt zich vriendelijk en goed georiënteerd. Hij was verhoogd afleidbaar, toonde gedachtevlucht en opvallende psychomotorische agitatie. Zijn spraak was onsamenhangend en tachyfreen. Hallucinaties waren er niet. Zijn stemming was euforisch met labiel affect. Er waren geen tekenen van recent drugsgebruik of ontwenningsverschijnselen. Hij had geen suïcidale gedachten, had een normale eetlust en gaf aan een ongestoord slaappatroon te hebben. Ziekte-inzicht was afwezig. Neurologisch onderzoek toonde, behoudens een lichte bilaterale tremor in zijn handen, geen bijzonderheden. Hij vermeldde af en toe hoofdpijn te hebben, en episodes van paresthesieën in de armen. Er was geen sprake van alcoholgebruik, maar hij gebruikte dagelijks cannabis, al vele jaren.
Op 29-jarige leeftijd werd patiënt opgenomen met een ernstige manie met psychotische kenmerken en werd hij succesvol behandeld met olanzapine. Na het verdwijnen van de manie kreeg hij lichte depressieve symptomen en kreeg hij voor een korte periode een antidepressivum voorgeschreven. Een profylactische behandeling met olanzapine, 5 mg per dag, werd ingesteld. Uit de familiale voorgeschiedenis vernamen we een psychotische episode bij de broer.
Bij patiënt werd eerder al de ziekte van Fahr vermoed: op zijn 15de toonde een computertomografie (CT) van de hersenen, naar aanleiding van terugkerende hoofdpijn, diffuse intracraniële calcificaties. Magnetische-resonantiebeeldvorming (MRI) van de hersenen liet hyperintense structuren in de basale ganglia zien. Het elektro-encefalogram (eeg) was normaal. Laboratoriumonderzoek toonde een licht verminderde concentratie van parathyreoïdhormoon (PTH) met normale calcium- en fosfaatwaarden. Serologische tests voor toxoplasmose en loodbepalingen waren negatief. Een lumbaalpunctie werd niet uitgevoerd.
Het laboratoriumonderzoek bij de huidige opname toonde geen bijzonderheden; met name calcium-, fosfaat- en PTH-waarden lagen binnen de normale grenzen, waardoor hypoparathyreoïdie en pseudohypoparathyreoïdie konden worden uitgesloten.
Gezien de ziektegeschiedenis en de mogelijke diagnose van de ziekte van Fahr, werd een CT-scan van de hersenen herhaald. Deze toonde de aanwezigheid aan van symmetrische calcificaties in de basale ganglia, de thalami en de subcorticale witte stof, voornamelijk in de frontale lobben (figuur 1).
Figuur 1. CT-scan van de hersenen (zonder contrast)
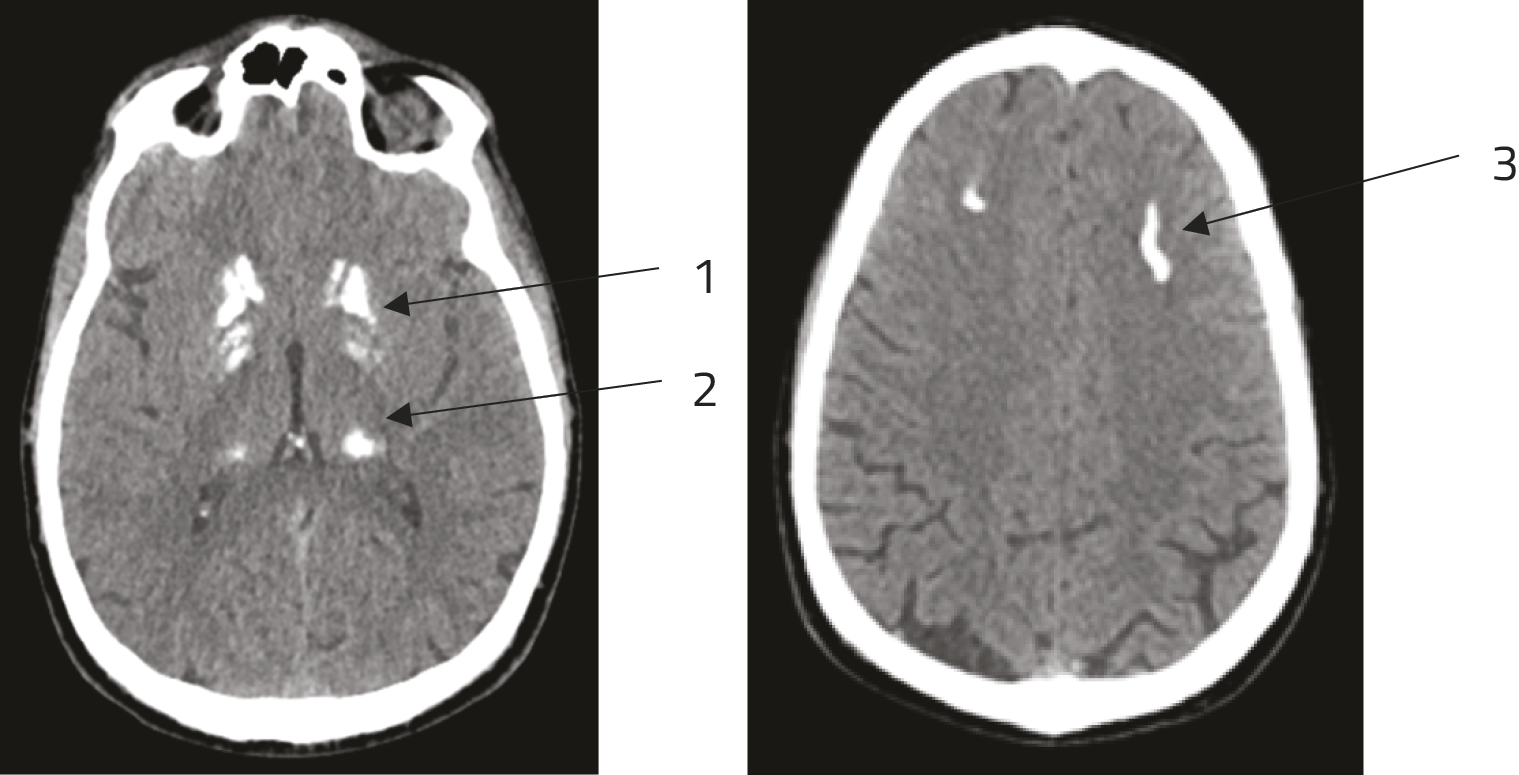
Symmetrische calcificaties t.h.v. de basale ganglia (1), thalami (2) en subcorticale witte stof, voornamelijk in de frontale lobben (3).
De waarschijnlijkheidsdiagnose van de ziekte van Fahr werd gesteld op basis van het klinische beeld in combinatie met de bilaterale calcificaties op de CT-scan.
De MRI toonde symmetrische calcificaties aan in de frontale lobben, de basale ganglia, de thalami en in beperkte mate de pariëtale lobben, uitsluitend op de susceptibility weighted image (SWI) (figuur 2).
Figuur 2. MRI-scan van de hersenen
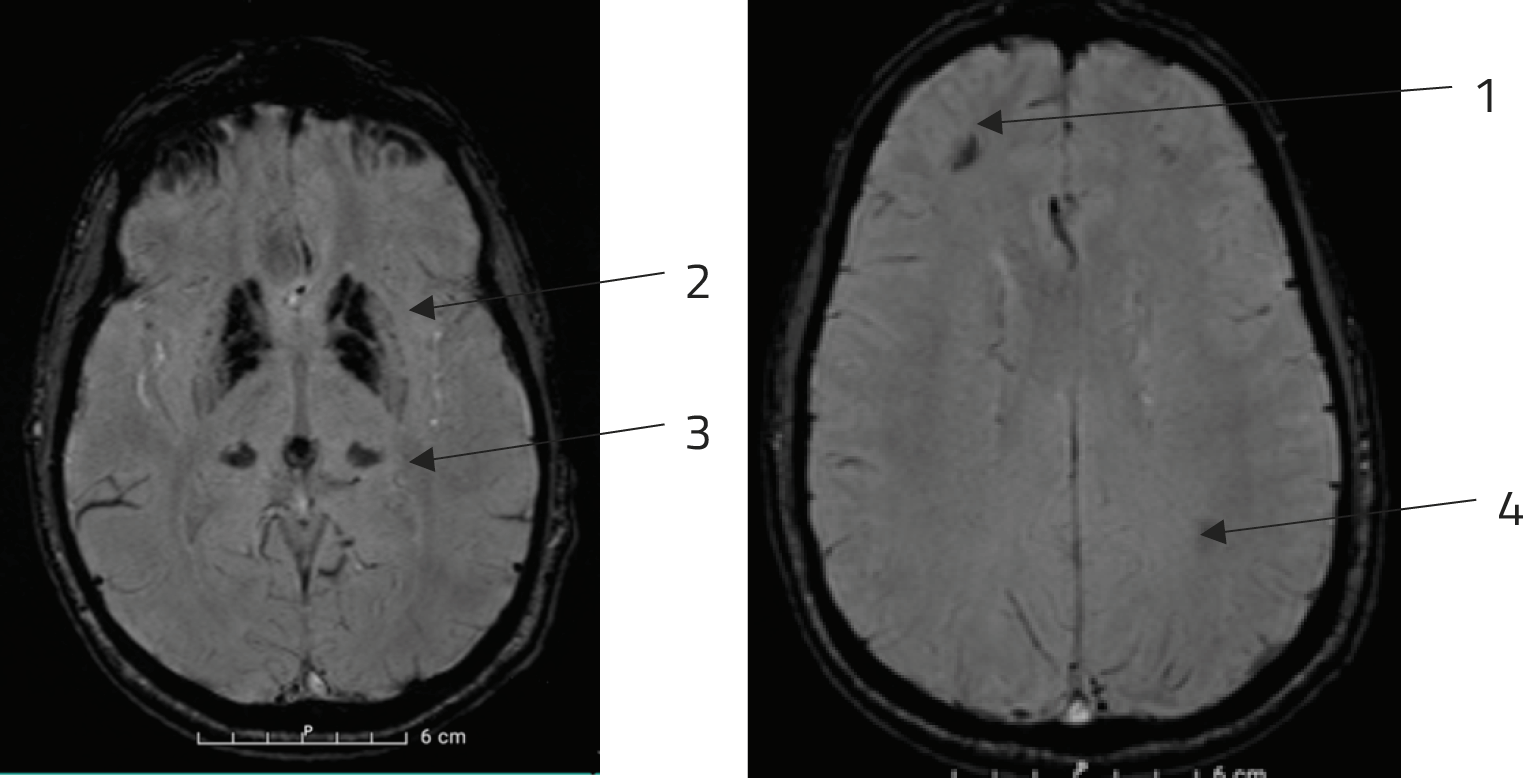
Symmetrische calcificaties in de frontale lobben (1), basale ganglia (2), thalami (3) en in beperkte mate pariëtale lobben (4), uitsluitend op de susceptibility weighted image (SWI).
De diagnose van een bipolaire stemmingsstoornis type 1 (ernstige manie met psychotische kenmerken) als gevolg van een andere medische aandoening werd gesteld.
Na vier weken behandeling met olanzapine 20 mg per dag was er sprake van remissie, maar patiënt kreeg extrapiramidale symptomen, die goed reageerden op behandeling met een anticholinergicum (procyclidine 2,5 mg drie keer daags). Profylactische behandeling met lithium (800 mg per dag) werd gestart. Na drie maanden opname, waarbij de focus lag op het vinden van structuur en zinvolle dagbesteding, kon hij het ziekenhuis verlaten en werd hij verder poliklinisch gevolgd.
Een maand na zijn ontslag meldde patiënt lichte depressieve symptomen, zoals somberheid en anhedonie, zonder vitale kenmerken, ondanks therapeutische lithiumspiegels (0,69 mmol/l). Deze symptomen bleken van voorbijgaande aard. Gedurende een follow-up van twee jaar bleef de stemming euthym. De dosis olanzapine werd geleidelijk verlaagd naar 4 mg vanwege leversteatose. Neurologisch vertoonde hij een subtiele tremor, waarschijnlijk gedeeltelijk gerelateerd aan lithium.
Bespreking
Pathofysiologie/etiologie
Bij de ziekte van Fahr worden symmetrische calcificaties waargenomen die niet-atheromateus zijn en bestaan uit een combinatie van zink, ijzer, aluminium, magnesium, silicium, koper en fosfor, maar vooral calcium, wat bijdraagt aan het radiologische beeld van de ziekte.4 Deze afzettingen worden vooral aangetroffen in de basale ganglia, maar kunnen ook andere hersengebieden zoals de thalamus, de nucleus dentatus (in het cerebellum) en de subcorticale witte stof aantasten.5 Het pathofysiologische mechanisme van de ziekte is nog niet volledig begrepen, maar pathologische studies tonen veranderingen aan in cerebrale microvaten en perivasculaire regio’s.7,8
De diagnose wordt definitief als er bij genetisch onderzoek een bekende mutatie wordt aangetoond. Inmiddels zijn er vier causale genen geïdentificeerd met een autosomaal dominante overerving: SLC20A2, PDGFRB, PDGFB en XPR1.6 De belangrijkste oorzaak zijn mutaties in SLC20A2, die samen met mutaties in PDGFRB en PDGFB bij ongeveer 49% van de PFBC-families voorkomen. Mutaties in SLC20A2 leiden tot inhibitie van de intracellulaire fosfaatopname en daardoor tot toename van calciumfosfaat extracellulair. Mutaties in PDGFB of PDGFRB veroorzaken een pericytentekort, dat kan leiden tot een verstoring van de bloed-hersenbarrière met calciumdeposities in de vasculaire extracellulaire matrix.9 In recenter onderzoek heeft men drie genen met autosomaal recessief overervingspatroon geïdentificeerd, namelijk biallelische varianten in MYORG, JAM2 en NAA60.10 Aangezien in onze casus patiënt genetisch onderzoek weigerde, bleef het genetisch patroon onbekend en konden we de diagnose niet met zekerheid stellen.
Het klinische beeld kan variëren, zelfs bij patiënten met dezelfde mutatie, door verschillen in de pathogeniciteit van de mutaties, de penetrantie en expressiviteit van de aandoening, de ‘veerkracht’ van de hersenen en de locatie van de calciumafzettingen.6
Voor secundaire vormen van hersencalcificaties wordt de term syndroom van Fahr voorgesteld. Veelvoorkomende etiologische factoren omvatten hypoparathyreoïdie, die leidt tot verstoringen in de calcium- en fosforhuishouding zoals hyperfosfatemie en hypocalciëmie, en secundaire hypoparathyreoïdie na (sub)totale thyroïdectomie. Andere secundaire oorzaken zijn infecties, zoals het verworven immunodeficiëntiesyndroom (aids), toxoplasmose, brucellose, en intra-uteriene en perinatale congenitale infecties (met rubella-, cytomegalo- of herpes-simplexvirus). Tevens is er een correlatie tussen verhoogde loodniveaus en intracraniële calcificaties vastgesteld. Systemische lupus erythematosus (SLE), een auto-immuunziekte met multisystemische aantasting, kan eveneens hersencalcificaties veroorzaken bij tot 30% van de patiënten.6
In onze casus werden secundaire oorzaken zoals (pseudo)hypoparathyreoïdie uitgesloten, maar een hivtest en uitsluiting van SLE ontbraken. Klinisch onderzoek toonde echter geen afwijkingen aan hart, longen, gewrichten of huid, wat de relevantie hiervan verminderde.
Klinisch beeld
Het klinische beeld kan een heel spectrum van symptomen omvatten, van volledig asymptomatisch (30% van de patiënten) tot ernstige neurologische en psychiatrische symptomen.1,11
In een serie van 62 patiënten meldde 40% zich initieel met psychiatrische symptomen, zoals cognitieve stoornissen (dementie of delier), stemmings-, angststoornissen en psychotische stoornissen.3 Stemmingsstoornissen zijn de meest voorkomende psychiatrische stoornissen bij BGC, waarbij sommige onderzoeken aantonen dat manie kan voorkomen bij een derde van de patiënten die zich met psychiatrische symptomen melden.2,12
Vaak gerapporteerde neurologische symptomen, die bij ongeveer 50% van de patiënten met BGC voorkomen, zijn extrapiramidale bewegingsstoornissen, waaronder chorea, tremor, parkinsonisme, dystonie en myoclonus (bij 56%), epilepsie (bij 22%), hoofdpijn en syncope.2
Tot nu toe zijn er geen duidelijke verschillen gevonden in het klinische beeld tussen primaire vormen (ziekte van Fahr) en secundaire vormen. De enige bekende factor die verband houdt met het klinische beeld is de ontstaansleeftijd.1
Er worden drie klinische patronen van de ziekte onderscheiden:4
Infantiel type: zeer zeldzaam en heterogeen in etiologie, vaak geassocieerd met infantiele spasmen, microcefalie, blindheid en vroegtijdig overlijden.2
Early-onsettype: symptomen ontwikkelen zich meestal rond het 30ste levensjaar (tussen 20 en 40 jaar), gekenmerkt door psychiatrische symptomen (zoals psychotische en stemmingsstoornissen) en minder door neurologische symptomen.1
Late-onsettype: symptomen beginnen rond het 50ste levensjaar, voornamelijk gekenmerkt door dementie en bewegingsstoornissen.1
Onze patiënt meldde zich met een manische episode met psychotische kenmerken op 29-jarige leeftijd. Dit is kenmerkend voor de vroege vorm van de ziekte van Fahr, die vaak gepaard gaat met psychotische en stemmingsstoornissen, maar minder met bewegingsstoornissen.4 Deze leeftijd is echter ook typisch voor een klassieke bipolaire stoornis zonder de ziekte van Fahr, waarbij het in onze casus onmogelijk is om met zekerheid een causaal verband aan te tonen.
Het is raadzaam om de ziekte van Fahr te overwegen in de differentiële diagnose, vooral bij patiënten met een atypisch begin van psychiatrische symptomen (zoals een eerste manische episode na de leeftijd van 40 jaar), een blanco psychiatrische voorgeschiedenis, aanwezigheid van neurologische symptomen en duidelijke cognitieve stoornissen (figuur 3).13
Figuur 3. Stroomschema bij vermoeden van de ziekte of het syndroom van Fahr
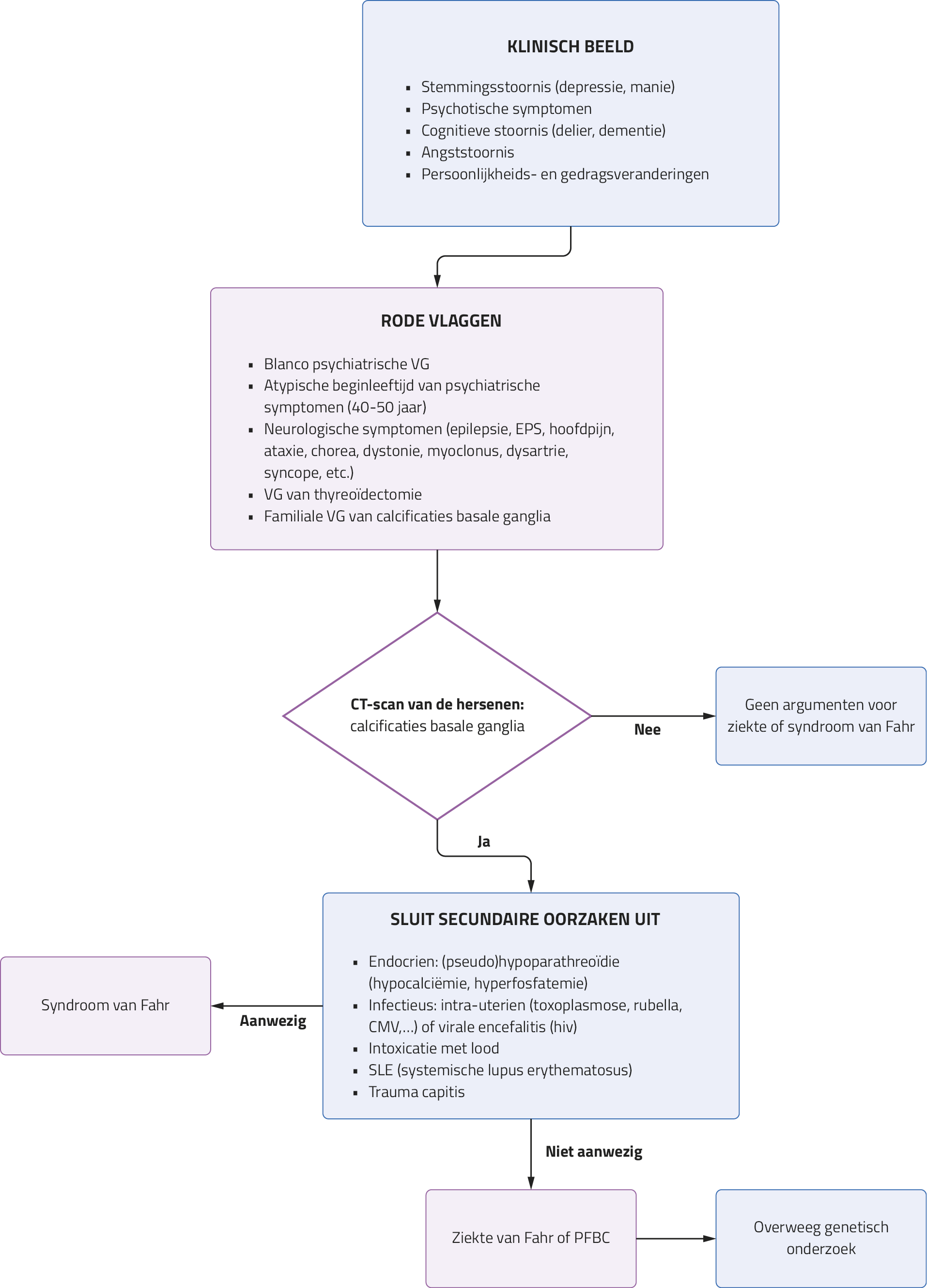
VG: voorgeschiedenis; EPS: extrapiramidaal syndroom; Ca: calcium; P: fosfaat; CMV: cytomegalovirus; hiv: humaan immunodeficiëntievirus; PFBC: primaire familiale calcificaties van de basale ganglia.
Diagnose
De diagnose van de ziekte van Fahr wordt gesteld op basis van calcificaties van de basale ganglia (meestal van de globus pallidus) op beeldvorming, gecombineerd met progressieve neurologische of psychiatrische symptomen, en zonder endocriene, infectieuze of toxische oorzaken.2,4 In onze casus stelden we de waarschijnlijkheidsdiagnose van de ziekte van Fahr op basis van het klinische beeld in combinatie met de bilaterale calcificaties op de CT-scan.
Een CT-scan zonder contrast heeft een grotere diagnostische specificiteit dan MRI.14 Eeg heeft een lage diagnostische waarde, door het ontbreken van een karakteristiek patroon.2,4
Bij bilaterale calcificaties van de basale ganglia op een CT-scan is het belangrijk om serumcalcium-, fosfaat- en PTH-spiegels te controleren om hypoparathyreoïdie uit te sluiten.1 Naast beeldvorming blijft psychiatrisch en neurologisch onderzoek essentieel voor de diagnose.4
Beeldvorming
Typische kenmerken op de CT-scan zijn bilaterale en symmetrische hyperdense afwijkingen, meestal gelokaliseerd in de basale ganglia. De globus pallidus is de meest betrokken structuur, hoewel ook andere structuren betrokken kunnen zijn.2,6
Susceptibiliteitsgewogen beelden (SWI) bij de MRI-scan zijn gevoeliger voor vroege veranderingen en detecteren verkalkingen nauwkeuriger dan andere MRI-sequenties, waarbij verkalkingen hypo-intens lijken op SWI.1,6 Omdat tot een derde van de patiënten geen symptomen heeft, kan een incidentele diagnose op de CT-scan voorkomen.5
In onze casus toonde de CT-scan van de hersenen de aanwezigheid van symmetrische calcificaties in de basale ganglia, de thalami en de subcorticale witte stof, voornamelijk in de frontale lobben. MRI toonde symmetrische calcificaties aan in de frontale lobben, de basale ganglia, de thalami en in beperkte mate de pariëtale lobben, uitsluitend op de SWI-beelden.
In de literatuur is er nog geen duidelijke causaliteit aangetoond tussen de ziekte van Fahr en manie. Er bestaat echter evidentie vanuit verschillende functionele beeldvormingsstudies dat er een verminderde activiteit is van de rechter ventromediale en -laterale prefrontale cortex en een verhoogde activiteit van de linker amygdala, anterieure cingulaire cortex en basale ganglia bij manie.15 Eerdere anatomische studies hebben ook al aangetoond dat veranderingen in de structuur en/of functie van de basale ganglia een rol kunnen spelen in de etiologie van manie.16 Dit pleit in onze casus voor het vermoeden van een secundaire manie.
Behandeling
Er is momenteel geen behandeling die de progressie van verkalkingen in de basale ganglia bij de ziekte van Fahr kan stoppen. Therapie richt zich daarom op het verlichten van de neuropsychiatrische symptomen.5,6,17
Volgens een review hadden 7 van de 10 patiënten (met een bipolaire stoornis en idiopathische calcificatie van de basale ganglia) baat bij een stemmingsstabilisator (valproïnezuur) en/of atypische antipsychotica (olanzapine of quetiapine), met verbetering van neurologische symptomen bij 4 patiënten.13 Er is momenteel onvoldoende wetenschappelijk bewijs voor de behandeling van parkinsonisme met levodopa.14
Elektroconvulsietherapie kan werkzaam zijn voor de behandeling van psychiatrische toestandsbeelden bij de ziekte van Fahr.5,13 Typische antipsychotica moet men vermijden, aangezien patiënten met de ziekte van Fahr gevoeliger kunnen zijn voor extrapiramidale symptomen en het maligne antipsychoticasyndroom.6,14,18
In onze casus stabiliseerde de stemming van de patiënt met olanzapine en lithium, waarbij anticholinerge medicatie nuttig bleek voor lichte EPS-klachten. Vanwege de anticholinerge activiteit en de lage kans op EPS-klachten kan olanzapine een uitstekende optie zijn voor de behandeling van een manie bij patiënten met de ziekte van Fahr.
Er zijn aanwijzingen dat de behandeling van secundaire oorzaken, zoals de correctie van de fosfaat- en calciumwaarde bij hypoparathyreoïdie, de neuropsychiatrische symptomen kan verbeteren.8,19 Bij een casus werd een patiënt met paranoïde wanen, veroorzaakt door hypoparathyreoïdie, behandeld met calcium- en vitamine D-supplementen. Na normalisatie van de calciumspiegel verbeterden de wanen.8 Er zijn aanwijzingen dat vroegtijdige behandeling van hypoparathyreoïdie calcificaties en neurofysiologische problemen kan voorkomen.20
Prognose
De ziekte van Fahr wordt gekenmerkt door een extreem variabel verloop, maar is meestal langzaam en progressief van aard.1,4
De behandeling van secundaire oorzaken kan ervoor zorgen dat sommige symptomen verdwijnen (zoals de correctie van fosfaat- en calciumspiegels bij hypoparathyreoïdie), waardoor ziekteprogressie wordt voorkomen en de prognose wordt verbeterd.19
Conclusie
Onze casus illustreert het belang van een blijvende aandacht voor onderliggende organische aandoeningen bij patiënten die zich met ernstige psychiatrische symptomen melden. Hersenbeeldvorming speelt hierin een belangrijke rol.
Patiënten met de ziekte van Fahr kunnen complexe, langzaam evoluerende symptomen vertonen, waaronder stemmingsstoornissen, motorische symptomen en cognitieve stoornissen. Het blijft nog onduidelijk in hoeverre er een causaal verband is tussen de ziekte van Fahr en de bipolaire stoornis. Het staat wel vast dat bij patiënten met de ziekte van Fahr de prevalentie van bipolaire stoornissen is verhoogd. Behalve terughoudendheid wat betreft voorschrijven van antipsychotica, kan men de algemene behandelrichtlijnen voor de bipolaire stoornissen volgen.
Literatuur
1 Savino E, Soavi C, Capatti E, e.a. Bilateral strio-pallido-dentate calcinosis (Fahr’s disease): Report of seven cases and revision of literature. BMC Neurol 2016; 16: 165.
2 Lauterbach EC, Cummings JL, Duffy J, e.a. Neuropsychiatric correlates and treatment of lenticulostriatal diseases: a review of the literature and overview of research opportunities in Huntington’s, Wilson’s, and Fahr’s diseases. J Neuropsychiatry Clin Neurosci 1998; 10: 249-66.
3 König P. Psychopathological alterations in cases symmetrical basal ganglia sclerosis. Biol Psychiatry 1989; 25: 459-68.
4 Jaworski K, Styczyńska M, Mandecka M, e.a. Fahr syndrome – An important piece of a puzzle in the differential diagnosis of many diseases. Pol J Radiol 2017; 82: 490-3.
5 Carbone MG, Della Rocca F. Neuropsychiatric manifestations of Fahr’s disease, diagnostic and therapeutic challenge: a case report and a literature review. Clin Neuropsychiatry 2022; 19: 121-31.
6 Donzuso G, Mostile G, Nicoletti A, e.a. Basal ganglia calcifications (Fahr’s syndrome): related conditions and clinical features. Neurol Sci 2019; 40: 2251-63.
7 Subedi S, Mukhi S, Pandey P. Fahr’s disease presenting with manic symptoms. JNMA J Nepal Med Assoc 2018; 56: 553-5.
8 Pourshahid S, Salloum MN, Elfishawi M, e.a. Fahr’s disease: a differential to be considered for various neuropsychiatric presentations. Cureus 2018; 10: e2304.
9 Peters MEM, De Brouwer EJM, Bartstra JW, e.a. Mechanisms of calcification in Fahr disease and exposure of potential therapeutic targets. Neurol Clin Pract 2020; 10: 449-57.
10 Chelban V, Aksnes H, Maroofian R, e.a. Biallelic NAA60 variants with impaired n-terminal acetylation capacity cause autosomal recessive primary familial brain calcifications. Nat Commun 2024; 15: 2269.
11 Ramos EM, Oliveira J, Sobrido MJ. Primary familial brain calcification. In: Adam MP, Ardinger HH, Pagon RA. GeneReviews [Internet]. Seattle: University of Washington; 2004.
12 Chhetri B, Gyeltshen D, Letho Z. Bipolar affective disorder in a patient with Fahr’s disease: The first recorded case in Bhutan. SAGE Open Med Case Rep 2022; 10: 2050313X221125324.
13 Ishitobi M, Kumashiro N, Nakao K. Clinical features of bipolar disorder with idiopathic basal ganglia calcification: a review of case reports in the literature. Neurocase 2019; 25: 145-50.
14 Aghemo K, Salmanzadeh R, DeAngelo O, e.a. Advanced early-onset Fahr’s disease: a case report. Cureus 2023; 15: e39495.
15 Cotovio G, Oliveira-Maia AJ. Functional neuroanatomy of mania. Transl Psychiatry 2022; 12: 29.
16 Johnson CP, Christensen GE, Fiedorowicz JG, e.a. Alterations of the cerebellum and basal ganglia in bipolar disorder mood states detected by quantitative T1ρ mapping. Bipolar Disord 2018; 20: 381-90.
17 Mufaddel AA, Al-Hassani GA. Familial idiopathic basal ganglia calcification (Fahr’s disease). Neurosciences (Riyadh) 2014; 19: 171-7.
18 Ghormode D, Maheshwari U, Kate N, e.a. Fahr’s disease and psychiatric syndromes: A case series. Ind Psychiatry J 2011; 20: 136.
19 Teodoro T, Oliveira R. Fahr’s syndrome and neuropsychiatric symptoms: Differential diagnosis in neuropsychiatry. Acta Medica Portuguesa Celom 2019; 32: 558.
20 Gatzk De Arruda AC, Damasceno AC, Guerra Z, e.a. Hypoparathyroidism and Fahr’s syndrome: case series. J Bras Nefrol 2022; 44: 592-6.
Authors
Bieke Daems, arts in opleiding tot psychiater, Universitair Psychiatrisch Centrum KU Leuven.
Kris Noppe, psychiater-psychotherapeut, Medisch Centrum St. Jozef, Munsterbilzen.
Pascal Sienaert, psychiater-psychotherapeut, UPC KU Leuven, Academisch Centrum voor ECT en Neuromodulatie (AcCENT), Kortenberg, en hoogleraar Psychiatrie, KU Leuven.
Correspondentie
Bieke Daems (bieke.daems@hotmail.com).
Geen strijdige belangen gemeld.
Het artikel werd voor publicatie geaccepteerd op 17-1-2025.
Citeren
Tijdschr Psychiatr. 2025;67(4):238-243
